
| A. | 苯 | B. | 乙醇 | C. | 溴苯 | D. | 乙酸 |
科目:高中化学 来源: 题型:选择题
| A. | 乙烯用途之一:可作为植物生长调节剂 | |
| B. | CH4与Cl2以体积比1:4混合,光照时可制得纯净的CCl4 | |
| C. | 苯能在一定条件下跟H2加成生成环己烷 | |
| D. | 工业上可用乙烯与水在一定条件下进行加成反应制取酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有乙烷 | B. | 一定是甲烷和乙烯 | ||
| C. | 一定有甲烷 | D. | 一定有乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
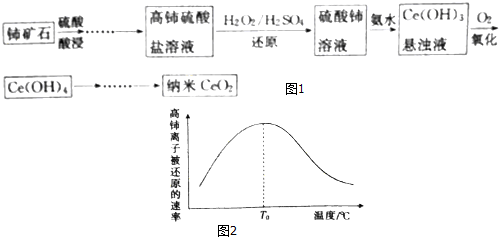
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
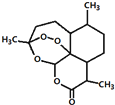
| A. | 用沸点只有35℃的乙醚作为溶剂来提取青蒿素的方法化学上叫萃取 | |
| B. | 能够发生水解反应 | |
| C. | 分子式为C15H23O5 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键或酯基等基团有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)=2c(CO32-)+c(HCO3-) | |
| D. | CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)+c(H+)=c(CH3COO-)+c(OH?)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上电解熔融的ZW制备Z单质 | |
| B. | 元素Y与Z形成的化合物中只能有一种化学键 | |
| C. | 离子半径大小顺序为W>X>Y>Z | |
| D. | 在一定条件下X的氢化物能与Y单质发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,将蒸发皿中固体完全蒸干后停止加热 | |
| B. | 过滤操作时,直接将过滤液慢慢向漏斗中倾倒 | |
| C. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸馏操作时,温度计下端应插入液面下 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com