
【题目】向一定质量的水中加入生石灰,下列曲线错误的是( )
A.  B.
B.  C.
C.  D.
D. 
【答案】D
【解析】
A、氧化钙与水反应生成氢氧化钙,溶液质量增加。当溶液饱和后溶液质量最大,继续加入氧化钙,氧化钙与水继续反应,当水反应完后,溶液质量为0,选项A正确;B、氧化钙与水反应生成氢氧化钙,溶质质量分数增大。当溶液饱和后,溶质质量分数最大;继续加入氧化钙,氧化钙与水继续反应,溶液温度升高,氢氧化钙溶解度变小,溶质质量分数减小,当水反应完后,溶液质量分数为0,选项B正确;C、氧化钙与水反应生成氢氧化钙,当加入氧化钙达到一定量时恰好与水完全反应,此时水的质量为0,选项C正确;D、氧化钙与水反应温度升高,当氧化钙恰好与水完全反应后温度最高,此后温度开始降低,但不会低于反应前的温度,选项D错误。答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2),无色液体,有类似氨的性质。已知:25℃时,Kb1=10-4.07Kb2=10-7.15;乙二胺溶液中各含氮微粒的分布分数δ(平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数)随溶液pH的变化曲线如右图。下列说法错误的是

A. H2NCH2CH2NH2在水溶液中第一步电离的方程式为:H2NCH2CH2NH2+H2O![]() H2NCH2CH2NH3++OH-
H2NCH2CH2NH3++OH-
B. 曲线Ⅰ代表的微粒符号为[H3NCH2CH2NH3]2+
C. 曲线Ⅰ与曲线Ⅱ相交点对应pH=4.07
D. 在0.1mol·L-1 H2NCH2CH2NH3Cl溶液中各离子浓度大小关系为c(Cl-)>(H2NCH2CH2NH3+) >c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物的化学式为[Cr(CH3COO)2]2·2H2O,该水合物通常为红棕色晶体,是一种常用的氧气吸收剂,不溶于水和乙醚(一种易挥发的有机溶剂),微溶于乙醇,易溶于盐酸,易被氧化。已知Cr3+水溶液呈绿色,Cr2+水溶液呈蓝色。实验室制备醋酸亚铬水合物的装置如下图所示。

(1)检查装置气密性后,向左侧三颈烧瓶中依次加入过量锌粒和适量CrCl3溶液,关闭K1打开K2,旋开a的旋塞,控制好滴速。a的名称是___________,此时左侧三颈烧瓶中发生反应的化学方程式为_______、________。一段时间后,整个装置内充满氢气,将空气排出。当观察到左侧三颈烧瓶中溶液颜色由绿色完全转变为蓝色时,关闭K2,打开K1,将左侧三颈烧瓶内生成的CrCl2溶液压入右侧三颈烧瓶中,则右侧三颈烧瓶中发生反应的离子方程式为________________________________________。
(2)本实验中所有配制溶液的水均需煮沸,其原因是______________________。右侧的烧怀内盛有水,其中水的作用是_______________________________________________。
(3)当观察到右侧三颈烧瓶内出现大量红棕色晶体时,关闭a 的旋塞。将红棕色晶体快速过滤、水洗、乙醚洗、干燥,即得到[Cr(CH3COO)2]2·2H2O。其中用乙醚洗涤产物的目的是_______________________。
(4)称量得到的[Cr(CH3COO)2]2·2H2O晶体,质量为m g,,若所取用的CrCl3溶液中含溶质n g,则[Cr(CH3COO)2]2·2H2O(M1=376 )的产率是______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)31Ga基态原子的核外电子排布式是___________。C、N、O三种元素第一电离能从大到小的顺序是____________。写出一种与 OH- 互为等电子体的分子为_________________(填化学式)。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_________;N2H4分子中氮原子轨道的杂化类型是_______。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
③图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是________(填标号)。
a. CF4 b. NH4+ c.CH4 d. H2O

(3)最近发现,只含C、Mg和Ni三种元素的某种晶体具有超导性。该晶体的一个晶胞如图3所示,则该晶体的化学式为 ___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是你,化学是我,化学深入我们生活。下列说法正确的是( )
A.木材纤维和土豆淀粉遇碘水均显蓝色
B.食用花生油和鸡蛋清都能发生水解反应
C.包装用材料聚乙烯和聚氯乙烯都属于烃
D.为了身体健康,不食用任何使用食品添加剂的食物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动都易导致糖尿病。
(1)血糖是指血液中的葡萄糖(C6H12O6)。下列说法正确的是________。
A.葡萄糖属于碳水化合物,其分子式可表示为C6(H2O)6,则每个葡萄糖分子中含6个H2O
B.糖尿病人尿糖高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
C.葡萄糖为人体提供能量
D.淀粉水解的最终产物是葡萄糖
(2)木糖醇[CH2OH(CHOH)3CH2OH]是一种甜味剂,糖尿病人食用后血糖不会升高。请预测木糖醇的一种化学性质:___________________________________________________。
(3)糖尿病人不可饮酒,酒精在肝脏内可被转化成有机物A。A的有关性质实验结果如下:
Ⅰ.通过样品的质谱测得A的相对分子质量为60。
Ⅱ.核磁共振氢原子光谱能对有机物分子中同效氢原子给出相同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:乙醇(CH3CH2OH)有三种氢原子(图甲)。经测定,有机物A的核磁共振氢谱示意图如图乙所示。

Ⅲ.将A溶于水,滴入石蕊试液,发现溶液变红。试写出A的结构简式:_________________________________________________。
(4)糖尿病人宜多吃蔬菜和豆类食品。蔬菜中富含纤维素,豆类食品中富含蛋白质。下列说法错误的是________(填序号)。
A.蛋白质都属于天然有机高分子化合物,且都不溶于水
B.用灼烧闻气味的方法可以区别合成纤维和羊毛
C.人体内不含纤维素水解酶,人不能消化纤维素,因此蔬菜中的纤维素对人没有用处
D.紫外线、医用酒精能杀菌消毒,是因为它们能使细菌的蛋白质变性
E.用天然彩棉制成贴身衣物可减少染料对人体的副作用
(5)香蕉属于高糖水果,糖尿病人不宜食用。乙烯是香蕉的催熟剂,它可使溴的四氯化碳溶液褪色,试写出该反应的化学方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象能正确反映对应变化关系的是( )
A. 加热高锰酸钾固体制取氧气
B. 对于一定浓度的氢氧化钠溶液加水稀释
C. 对于某温度下的接近饱和的硝酸钾溶液,加入硝酸钾固体
D. 向一定浓度的稀硫酸中加入等质量的镁和铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、保存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是______________(至少答出两点)。但是氢气直接燃烧的能量及转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:_____________________________。
(2)氢气可用于制备H2O2。已知:H2(g)+A(l)![]() B(l)ΔH1 O2(g)+B(l)
B(l)ΔH1 O2(g)+B(l)![]() A(l)+H2O2(l) ΔH2,其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)
A(l)+H2O2(l) ΔH2,其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)![]() H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)=MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变 b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大 d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH-)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是________________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,SO2和O2在催化剂500℃的条件下发生反应。SO2和SO3的物质的量随时间变化的关系曲线如图所示。
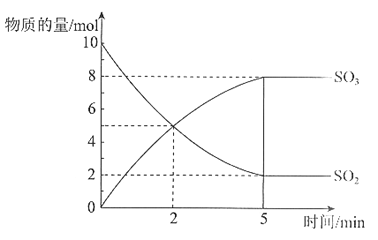
回答下列问题。
(1)该反应的化学方程式是_________。
(2)在前2 min内,以SO2的浓度变化表示的速率是_________mol/(L·min)。
(3)反应达到平衡状态的依据是_________。
a. 单位时间内消耗1 mol SO2,同时生成1 mol SO3
b. SO2的浓度与SO3浓度均不再变化
c. SO2的浓度与SO3浓度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com