
设NA为阿伏伽德罗常数的值,下列说法正确的是 ( )
A.0.1molN2与0.3molH2在密闭容器催化剂作用下充分反应,生成氨分子数为0.2NA
B.标准状况下,11.2L甲醛气体中电子数为8NA
C.常温常压下,7.8g苯中含有单键的数目为0.9NA
D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
运用相关化学知识进行判断,下列结论错误的是( )
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快 反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们溶于水,在水中电离出的阳离子有K+、Ag+,阴离子 有NO3-、OH-(电解质电离的离子有重复)。
有NO3-、OH-(电解质电离的离子有重复)。
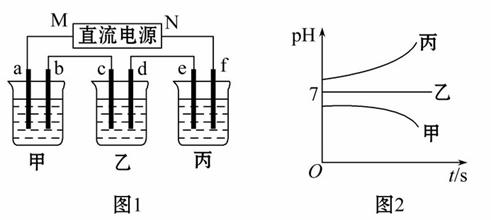
图1装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为铂电极。接通电源,经过一段时间后,测得甲中b电极质量增加了43.2 g。常温下各烧杯中溶液pH与电解时间t关系如图2所示。请回答下列问题:
(1)写出三种强电解质的化学式:A__________;B_________;C_________。
(2)写出乙烧杯c电极发生的电极反应为_________,甲烧杯中的总反应的化学方程式为____________________________________。
(3)计算丙烧杯e电极上生成的气体在标准状况下的体积为_________,甲烧杯中溶液体积为100 mL,pH=_________。
(4)要使甲烧杯中的A溶液恢复到电解前的状态,需要加入的物质是_________,其质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
类推思维是化学解题中常用的一种思维方法.下列有关离子方程式的类推正确的是( )
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+═Cu+2Na+ |
| B | 稀硫酸加入Ba(OH)2溶液至中性 2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O | NaHSO4溶液加入Ba(OH)2溶液至中性 H++SO42﹣+Ba2++OH﹣═BaSO4↓+H2O |
| C | 向氯化铝溶液中加入足量NaOH溶液 Al3++4OH﹣═AlO2﹣+2H2O | 向氯化铝溶液中加入足量氨水 Al3++4NH3•H2O═AlO2﹣+2H2O+4NH4+ |
| D | 向Ca(OH)2溶液中通入过量CO2 CO2+OH﹣═HCO3﹣ | 向Ca(OH)2溶液中通入过量SO2 SO2+OH﹣═HSO3﹣ |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年世界环境日中国主题为“同呼吸·共奋斗”,其中防治PM2.5是重点。PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是雾霾天气的主要原因,它主要来自化石燃料的燃烧,下列与PM2.5相关的说法不正确的是 ( )
A.大力发展电动车,减少燃油汽车的尾气排放量
B.开发利用各种新能源,减少对化石燃料的依赖
C.吸烟也会造成室内PM2.5污染
D.PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于钠和钠的化合物的叙述不正确的是( )
A. 热稳定性:Na2CO3>NaHCO3
B.Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
C.碳酸氢钠可用于治疗胃酸过多
D.Na2O2中阴、阳离子的个数比为1∶ 2
查看答案和解析>>
科目:高中化学 来源: 题型:
“温室效应”是哥奉哈根世界气候变化大会研究的环境问题之一。CO2气体在大气层中具有吸热和隔热的功能,是主要的温室气体。
(1)下列措施中,有利于降低大气中CO2浓度的是 (填字母编号)。
a.采用节能技术,减少化石燃料的用量
b.鼓励乘坐公交车出行,倡导“低碳”生活
c.利崩太阳能、风能等新型能源替代化石燃料 ·
(2)CH4是另一种主要的温室气体,l克甲烷完全燃烧生成液态水和二氧化碳,放出55.64 kJ的热量,写出甲烷的燃烧热的热化学方程式 。
(3)酸阿的形成主要是由废气中的SOx和NOx造成的。通过SO2和Br2、H2O的定量反应在电解池中产生的电流变化,可以准确测定空气中SO2的含量。该反应的化学方程式为 。
(4)某硫酸工厂以黄铁矿为原料生产硫酸。 第一阶段燃烧黄铁矿的化学方程式为4FeS2+11O2 2Fe2O3+8SO2;第二阶段的反应原理是2SO2(g)+O2(g)
2Fe2O3+8SO2;第二阶段的反应原理是2SO2(g)+O2(g) 2SO3(g),其生产设备的名称为接触室;在生产过程中某一时刻取样分析:SO2、O2、SO3的浓度分别为2mol·L-1、2mol·L-1、3mol·L-1,当反应达到平衡时,可能存在的数据是 (填字母编号)
2SO3(g),其生产设备的名称为接触室;在生产过程中某一时刻取样分析:SO2、O2、SO3的浓度分别为2mol·L-1、2mol·L-1、3mol·L-1,当反应达到平衡时,可能存在的数据是 (填字母编号)
a. SO2为5mol·L-1,O2为3.5mol·L-1 b. SO2为3mol·L-1
c. SO2、SO3均为2.5mol·L-1 d. SO3为5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是
( )
|
| A. | ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓ |
|
| B. | 原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ |
|
| C. | 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
|
| D. | d点溶液中含有的溶质只有NaAlO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com