
| A. | Na | B. | Si | C. | S | D. | Cl |
科目:高中化学 来源: 题型:解答题
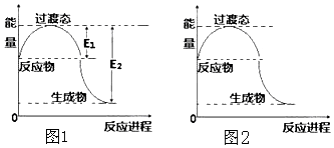 回答下列问题:
回答下列问题:| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能(kJ/mol) | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
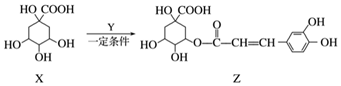
| A. | Z结构中有1个手性碳原子 | |
| B. | Y的分子式为C9H8O4 | |
| C. | 1 mol Z与足量NaOH溶液反应,最多消耗8 mol NaOH | |
| D. | Z与浓溴水既能发生取代反应又能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+物质的量为0.2mol | B. | Na+物质的量浓度为0.2 mol•L-1 | ||
| C. | SO42-物质的量为0.1mol | D. | SO42-物质的量浓度为0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥ | B. | ①②③⑤⑥ | C. | ①②③⑤⑦ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=7 | B. | c(H+)=c(OH-) | ||
| C. | c(H+)=c(OH-)=10-7mol/L | D. | c(H+)•c(OH-)=10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
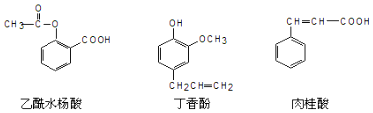
| A. | ②与③ | B. | ③与④ | C. | ①与④ | D. | ①与② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com