
《全球科技经济瞭望》报道了美国氢燃料电池技术的发展.科学家预测“氢能”将是未来21世纪最理想的新能源,氢能是利用氢气的燃烧反应放热提供能量.
即:H2(g)+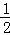 O2(g)═H2O(l)△H=﹣285.5kJ/mol.
O2(g)═H2O(l)△H=﹣285.5kJ/mol.
(1)试分析“氢能”将是未来21世纪最理想的新能源的原因 ; (指出两个优点即可).
(2)目前世界上的氢气绝大部分是从石油、煤炭和天然气中制取.请写出工业上由天然气与H2O(g)反应制氢气的化学反应方程式 .
(3)利用硫﹣碘热循环法制取氢气也是化学家常用的一种方法,总反应方程式为2H2O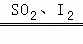 2H2↑+O2↑,其循环过程分三步进行:
2H2↑+O2↑,其循环过程分三步进行:
(a)SO2+I2+H2O→A( )+B( )
(b)A( )→ H2 + I2
(c)B( )→ + + H2O
完成以上三步反应,并确定最难进行的反应为 .
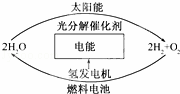
(4)目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示,这是一种最理想的氢能源循环体系,类似于生物的光合作用,太阳能和水是用之不竭的,而且价格低廉.急需化学家研究的是 .
考点:
清洁能源;常见的能量转化形式.
专题:
化学反应中的能量变化.
分析:
(1)运用氢气燃烧只生成水无污染的性质解答;
(2)仿照用水蒸气与炽热的碳反应为 C+H2O═CO+H2 解答;
(3)根据SO2和I2的氧化还原反应产物来分析本题,并结合物质的稳定性来解答反应的难易;
(4)运用光合作用的循环体系和开发氢能原面临的问题解答.
解答:
解:(1)水做原料制氢资源丰富;燃烧产物是水无污染;发热量高所以氢能是未来最理想的新能源,故答案:用水做原料制氢资源丰富;燃烧产物是水无污染;
(2)该反应式的书写要注意工业上充分利用天然气,获得更多的氢气,必须利用廉价的水来提供氢,而不是直接分解.另外产物是二氧化碳,而不是一氧化碳,这样甲烷的利用率才更高.故反应式为CH4+2H2O(g) CO2+4H2,故答案为:CH4+2H2O(g)
CO2+4H2,故答案为:CH4+2H2O(g) CO2+4H2;
CO2+4H2;
(3)根据SO2和I2在水溶液中发生氧化还原反应,SO2被氧化为H2SO4,I2被还原为HI,故反应为:SO2+I2+2H2O═2HI+H2SO4;
再根据A的分解产物只有两种,故A为HI,分解反应为:2HI H2+I2;
H2+I2;
分解为B的分解产物有三种,故B为H2SO4,分解反应为:2H2SO4═2SO2↑+O2↑+2H2O;
由于硫酸很稳定,所以反应(c)最难进行,
故答案为:(a)SO2+I2+2H2O═2HI+H2SO4
(b)2HI H2+I2
H2+I2
(c)2H2SO4═2SO2↑+O2↑+2H2O
反应(c)最难进行;
(4)由图可见,科学家需研究出合适的光分解催化剂,它能在光照下促使水的分解速率加快.故答案为:合适的光分解催化剂.
点评:
能源问题是当今世界的热点问题,新能源的开发和利用问题结合有关化学知识的考查成为中考的热点之一.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
化学上常用燃烧法确定有机物的组成.如图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品.根据产物的质量确定有机物的组成.
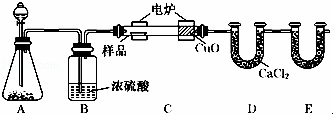
回答下列问题:
(1)A装置中分液漏斗盛放的物质是 H ,写出有关反应的化学方程式 .
(2)C装置(燃烧管)中CuO的作用是 .
(3)写出E装置中所盛放试剂的名称 ,它的作用是 .
(4)若将B装置去掉会对实验造成什么影响? .
(5)若准确称取1.20g样品(只含C、H、O三种元素中的两种或三种).经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为 .
(6)要确定该有机物的化学式,还需要测定 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:
①H2(g)+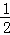 O2(g)═H2O(g)△H1=a kJ•mol﹣1②2H2(g)+O2(g)═2H2O(g)△H2=b kJ•mol﹣1
O2(g)═H2O(g)△H1=a kJ•mol﹣1②2H2(g)+O2(g)═2H2O(g)△H2=b kJ•mol﹣1
③H2(g)+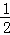 O2(g)═H2O(l)△H3=c kJ•mol﹣1④2H2(g)+O2(g)═2H2O(l)△H4=d kJ•mol﹣1
O2(g)═H2O(l)△H3=c kJ•mol﹣1④2H2(g)+O2(g)═2H2O(l)△H4=d kJ•mol﹣1
下列关系式中正确的是( )
|
| A. | a<c<0 | B. | b>d>0 | C. | 2a=b<0 | D. | 2c=d>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
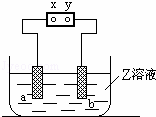
如图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )
| a极板 | b极板 | X电极 | 电解质溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
德国化学家凯库勒认为,苯分子的结构中碳碳间以单、双键交替排列结合成环状.为了验证凯库勒的观点,某学生设计了以下实验方案:
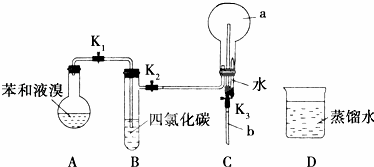
①按如图所示的装置连接好仪器;
②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开K1、K2、K3止水夹;
④待烧瓶C中收集满气体后,将导管b的下端插入烧杯D里的水中,挤压预先盛有水的胶头滴管,观察实验现象.
(1)A中所发生反应的反应类型为 ,能证明凯库勒观点错误的实验现象是 .
(2)装置B的作用是 .
(3)烧瓶C的容积为500mL,收集气体时,由于空气未排尽,最终水未能充满烧瓶,假设烧瓶中混合气体对氢气的相对密度为37.9,则实验结束后,进入烧杯中的水的体积为 mL(空气的相对分子质量以29计算).
查看答案和解析>>
科目:高中化学 来源: 题型:
1体积SO2和3体积空气混合后,在450℃以上通过V2O5催化剂,发生如下反应:2SO2(g)+O2(g)⇌2SO3(g)若同温同压下测得反应前后混合气体的密度比为0.9:1,则反应掉的SO2是原有SO2的百分之几?
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2O含有的分子数为1NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA
C. 通常状况下,1NA个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2(g)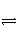
 N2O4(g) ΔH<0)
N2O4(g) ΔH<0)

(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”)。
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通人等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com