
离子键、共价键、和范德华力是构成物微粒之间的不同作用力。下列物质中只含有上述一种作用力的是
A、冰 B、氯化钠 C、氢氧化钠 D、碘
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A.C60是一种新的化合物,具有全部由共价键组成的空间网状结构
B.C60和石墨都是碳的同素异形体
C.C60中含离子键、共价键、配位键
D.C60的相对分子质量是720,存在范德华力,熔沸点较低
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学-物质结构与性质]13分
(1)元素的第一电离能:Al Si(填“>”或:“<”)
(2)基态Mn2+的核外电子排布式为 。
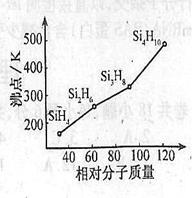
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如右图所示,呈现这种变化关系的原因是 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm—(含B、O、H三种元素)的球棍模型如右下图所示:
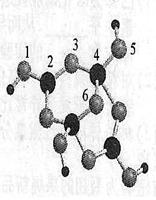
①在Xm—中,硼原子轨道的杂化类型有 ;配位键存在于 原子之间(填原子的数字标号);
m= (填数字)。
②硼砂晶体由Na+、Xm—和H2O构成,它们之间存在的作用力有 (填序号)。
A.离子键 B.共价键 C.金属键
D.范德华力 E.氢键
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期期中考试化学试卷(解析版) 题型:选择题
氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+、N2H62+等。回答以下问题:
(1)N的基态原子中,有 个运动状态不同的未成对电子。
(2)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布式是_______。
(3)NH3、N2H4、NH4+、N2H62+四种微粒中,同种微粒间能形成氢键的有____________;不能作为配位体的有____________。
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因 是 。
(5)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子的杂化类型是______。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)
若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
(6)肼能与硫酸反应生成N2H6SO4。N2H6SO4化合物类型与硫酸铵相同,则N2H6SO4 内微粒间作用力不存在_______(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
查看答案和解析>>
科目:高中化学 来源:2012届吉林省高二下学期期中考试化学试卷 题型:选择题
下列说法,正确的是
A.离子键具有饱和性和方向性
B.范德华力是分子间作用力的一种,氢键不属于分子间作用力
C.s轨道与s轨道之间可以在任何方向上成键,所以共价键都没有方向性
D.s轨道与p轨道只有沿着一定的方向,才能发生最大程度的重叠,形成共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com