
【题目】研究含N、S的污染排放物并妥善处理和利用,意义重大。回答下列问题:
(1)![]() 尾气先用氨水吸收生成
尾气先用氨水吸收生成![]() ,反应为
,反应为![]()
![]() ,再将
,再将![]() 氧化为
氧化为![]() ,最终实现副产氮肥,变废为宝。两种氧化方案如下:
,最终实现副产氮肥,变废为宝。两种氧化方案如下:
方案1:![]()
方案2:![]() ,
,
![]() 。
。
30℃时,分别向两相同容器中加入100L 0.4![]() 溶液,加入足量相同物质的量的氧化剂,测得
溶液,加入足量相同物质的量的氧化剂,测得![]() 的氧化率X(%)随时间的变化如图所示。
的氧化率X(%)随时间的变化如图所示。
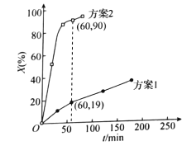
据上述图像判断,氧化![]() 为
为![]() 的能力是
的能力是![]() ____(填“大于”或“小于”)
____(填“大于”或“小于”)![]() ,可能的原因是___。
,可能的原因是___。
②60min内测得方案2体系中用![]() 表示的反应速率为__
表示的反应速率为__![]() 。
。
(2)方案2中,![]() 会被氧化成
会被氧化成![]() ,而
,而![]() 不能结合氧气(活化分子氧),为了保持钴氨溶液的吸收能力,需添加
不能结合氧气(活化分子氧),为了保持钴氨溶液的吸收能力,需添加![]() 将
将![]() 还原成
还原成![]() ,同时生成
,同时生成![]() 。反应历程如下:
。反应历程如下:
i:![]()
ii:_____
iii:![]()
iv:![]()
则第ii步反应为____。
(3)利用废气中的![]() 将(2)中生成的
将(2)中生成的![]() 还原成
还原成![]() ,以实现
,以实现![]() 再生。反应的离子方程式为____。
再生。反应的离子方程式为____。
![]() 再生后,实现了利用方案2完整地氧化
再生后,实现了利用方案2完整地氧化![]() 为
为![]() 的过程,则整个过程中起催化剂作用的是___(填离子符号)。
的过程,则整个过程中起催化剂作用的是___(填离子符号)。
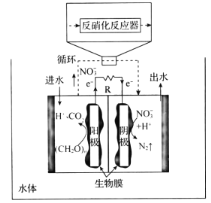
(4)关于微生物电化学系统处理含氮废水的研究快速发展,如图是一种新型的浸没式双极室脱盐-反硝化电池。由阳极室和阴极室组成,中间由质子交换膜隔开,阳极室中的有机物则被微生物氧化降解产生电子和质子,其中的![]() 通过泵循环至阴极室,经过反硝化反应器中反硝化菌的作用被还原成
通过泵循环至阴极室,经过反硝化反应器中反硝化菌的作用被还原成![]() 。
。
①微生物电化学系统处理有机含氮废水的优点是____。
②写出负极发生反应的电极反应式:_____。
【答案】大于 具有过氧键,有强氧化性 69.6 ![]()
![]()
![]() 、
、![]() 能耗低,以及在产生电能的同时可以进行脱氮消除污染
能耗低,以及在产生电能的同时可以进行脱氮消除污染 ![]()
【解析】
(1)①单位时间内亚硫酸铵的氧化率高,说明反应速率快,分析结构特点不难得出氧化![]() 为
为![]() 的能力是
的能力是![]()
![]() 大于
大于![]() 的原因是其具有过氧键,有强氧化性。②60min内测得方案2体系中亚硫酸铵的氧化量为36mol,计算可得速率为69.6
的原因是其具有过氧键,有强氧化性。②60min内测得方案2体系中亚硫酸铵的氧化量为36mol,计算可得速率为69.6![]() 。
。
(2)反应历程i~iv对应的总反应为添加![]() 将
将![]() 还原成
还原成![]() :
:![]() ,所以第ii步反应为
,所以第ii步反应为![]() 。
。
(3)![]() 与
与![]() 反应的离子方程式为
反应的离子方程式为![]()
![]() ,
,![]() 再生后,实现了利用方案2完整地氧化
再生后,实现了利用方案2完整地氧化![]() 为
为![]() 的过程,总过程可表示为
的过程,总过程可表示为![]() ,所以整个过程中起催化剂作用的是
,所以整个过程中起催化剂作用的是![]() 、
、![]() 。
。
(4)①分析微生物电化学系统,其优点为能耗低,以及在产生电能的同时可以进行脱氮,消除污染。②负极即电池内电路阳极上发生的反应为![]() 。
。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】已知![]() 在不同的溶剂中可形成不同的分散系:
在不同的溶剂中可形成不同的分散系:![]() 溶解在水中形成无色透明的分散系一;
溶解在水中形成无色透明的分散系一;![]() 溶解在乙醇中形成无色透明的分散系二。下列说法正确的是( )
溶解在乙醇中形成无色透明的分散系二。下列说法正确的是( )
A. 分散系二与雾、霾为同一种类型的分散系
B. 在两个分散系中,![]() 都是以
都是以![]() 和
和![]() 的形式存在
的形式存在
C. 分散系二中,分散质粒子的个数为![]() 个
个
D. 两个分散系都是电解质且性质较稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动小组利用废铁屑(含少量S等元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体![]() 并测定其组成。实验一:制备硫酸亚铁铵
并测定其组成。实验一:制备硫酸亚铁铵![]() 。小组同学设计如图所示装置(夹持仪器略去)。
。小组同学设计如图所示装置(夹持仪器略去)。
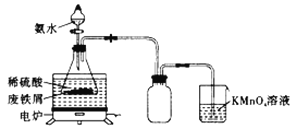
称取一定量的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50~60℃热水浴中加热,充分反应。待锥形瓶中溶液冷却后加入氨水,搅拌使其反应完全,制得浅绿色悬浊液。
(1)废铁屑在使用前需要用热的饱和碳酸钠溶液进行洗涤,目的是______________________________。
(2)在实验中选择50~60℃热水浴的原因是___________________________,![]() 溶液的作用是________________________。
溶液的作用是________________________。
(3)若要确保获得浅绿色悬浊液,实验过程应注意的是___________(填字母)。
a.保持铁屑过量 b.控制溶液呈强酸性 c.持续升高温度
实验二:制备三草酸合铁(Ⅲ)酸钾晶体。
实验小组用实验一锥形瓶中的悬浊液设计以下实验流程制备三草酸合铁(Ⅲ)酸钾晶体。
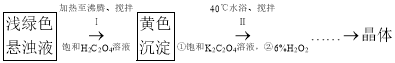
(4)写出步骤Ⅰ生成黄色沉淀![]() 的化学方程式:____________________。
的化学方程式:____________________。
(5)小组同学准确称取了mg废铁屑,经过以上步骤(假设过程中铁没有损失)得到三草酸合铁(Ⅲ)酸钾晶体并配制成了250mL溶液,取25mL该溶液于锥形瓶中,加入![]() 硫酸溶液15mL,滴入二苯胺磺酸钠作指示剂,用
硫酸溶液15mL,滴入二苯胺磺酸钠作指示剂,用![]() 的
的![]() 标准液滴定至紫红色,进行了三次平行实验,平均消耗标准液
标准液滴定至紫红色,进行了三次平行实验,平均消耗标准液![]() ,已知
,已知![]() 在酸性介质中被还原为
在酸性介质中被还原为![]() ,则废铁屑中铁元素的质量分数为________(用相关字母表示)。
,则废铁屑中铁元素的质量分数为________(用相关字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】定条件下存在反应:H2(g)+I2(g) ![]() 2HI(g) △H<0.现有三个相同的1L恒容绝热(与外界没有热量交换)态闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入lmolH2和1molⅠ2(g),在Ⅱ中充入2molHl(g).在Ⅰ中充入2molH2和2molI2 (g),700℃条件下开始反应。达到平衡时,下列说法正确的是()
2HI(g) △H<0.现有三个相同的1L恒容绝热(与外界没有热量交换)态闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入lmolH2和1molⅠ2(g),在Ⅱ中充入2molHl(g).在Ⅰ中充入2molH2和2molI2 (g),700℃条件下开始反应。达到平衡时,下列说法正确的是()
A. 容器Ⅰ、Ⅱ中反应速率相同
B. 容器Ⅰ、Ⅲ中反应的平衡常数相同
C. 容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色浅
D. 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体的健康有赖于体内各种元素的均衡摄入。
(1)正常人一天的食盐摄入量不超过 6g。
①除去 NaCl溶液中的SO42-,依次加入的溶液为(填溶质的化学式):过量______溶液、过量______溶液、适量稀盐酸。
②食用碘盐是食盐中加入 KIO3。下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。回答下列问题:
配料表 | 精制海盐、碘酸钾(KIO3) |
含碘量 | 20~40 mg/kg |
储藏方法 | 密封避光、防潮 |
食用方法 | 烹调时待食品熟后加入碘盐 |
食用碘盐中“碘”是指______(填“碘离子”或“碘元素”)。推测出碘酸钾(KIO3)化学性质:碘酸钾(KIO3)在高温时______(填“易分解”或“不易分解”)。一种测定含碘量的化学原理是:
(Ι)KIO3 + KI + H2SO4===K2SO4 + I2 + H2O(未配平),
(Ⅱ)I2 + 2Na2S2O3 = 2NaI + Na2S4O8。将反应 Ι 改写为离子方程式_____
(2)成人每天从食物中摄取 0.8 g Ca 元素、0.3 g Mg 元素。
①Ca 元素与 Mg 元素物质的量之比为______。
②墨鱼骨粉(主要成分是 CaCO3),可用作治疗胃酸过多,其原因是_________(用离子方程式回答)。
③从海水中可提取镁:除去混在 Mg(OH)2 中的 Ca(OH)2 的最佳方法是:加入过量的______(填“A”或“B”)(A. MgSO4 溶液 B. MgCl2 溶液),过滤,洗涤,低温烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁在海水中的锈蚀过程示意见图,有关说法正确的是
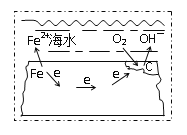
A.电子从碳转移给铁
B.在钢铁上连接铅块,可起到防护作用
C.正极反应为:O2 + 2H2O + 4e- =4OH-
D.钢管发生析氢腐蚀,负极反应是Fe—3e- =Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
A. 0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol
B. 达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C. 达到化学平衡状态时,反应放出的总热量可达a Kj
D. 升高反应温度,逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家近期研发出如图所示的水溶液锂离子电池体系,下列有关叙述错误的是
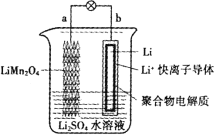
A.b电极不可用石墨替代Li
B.正极反应为:Li1-xMn2O4+xLi++xe- = LiMn2O4
C.电池总反应为:Li1-xMn2O4+xLi = LiMn2O4
D.放电时,溶液中Li+从a向b迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)钒是第四周期元素,工业上有广泛应用。写出钒原子的价电子排布图______________,V2O5常用作SO2转化为SO3的催化剂,S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型为_________________.
![]()
(2)光气(COCl2)是一种重要的有机中间体,其分子的立体构型为_________,其三种元素的电负性由小到大的顺序为___________________,写出与COCl2互为等电子体的分子和离子:___(各写一种)。
(3)[Co(N3)(NH3)5]SO4中Co的配位数为_________,其配离子中含有的化学键类型为__________,C、N、O中第一电离能最大的为_______,其原因是____________________。
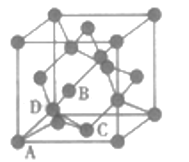
(4)如图为金刚石的晶胞,其中原子坐标参数为A(0,0,0);B(![]() ,0,
,0,![]() );C(
);C(![]() ,
,![]() ,
,![]() );则D原子的坐标参数为__________。
);则D原子的坐标参数为__________。
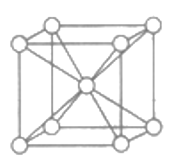
(5)晶体锌为体心立方结构,如图所示。已知锌晶体的密度为dg/cm3,NA代表阿伏加德罗常数的值。锌晶体中锌原子之间最近的核间距(D)=_______mm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com