
【题目】下列各组物质混合后,不能生成NaOH的是
A.Na和H2OB.Ca(OH)2溶液和NaCl溶液
C.Na2O2和H2OD.Ca(OH)2溶液和Na2CO3溶液
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
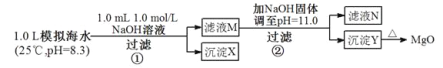
注:溶液中某种离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )
A. 沉淀物X为CaCO3
B. 滤液M中存在Mg2+,不存在Ca2+
C. 滤液N中存在Mg2+,Ca2+
D. 步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用铁泥(主要成分为Fe2O3、FeO和少量Fe)制备Fe3O4纳米材料的流程示意图如下:


已知:步骤⑤中,相同条件下测得Fe3O4的产率与R( )的关系如图所示。
)的关系如图所示。
(1)为提高步骤①的反应速率,可采取的措施是_______________(任写一点) 。
(2)步骤②中,主要反应的离子方程式是________________________。
(3)浊液D中铁元素以FeOOH形式存在。步骤④中,反应的化学方程式是___________________;步骤④中,反应完成后需再加热一段时间除去剩余H2O2目的是____________________________
(4)⑤反应的离子方程式为_________________ ;步骤⑤中的“分离”包含的步骤有______________________。
(5)设浊液D中FeOOH的物质的量为amol,滤液B中的铁元素的物质的量为bmol。为使Fe3O4的产率最高,则![]() =_________。(填数值,小数点后保留3位)
=_________。(填数值,小数点后保留3位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0 mL于锥形瓶中,加入10.0 mL的KI溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。
②取一滴定管依次用自来水、蒸馏水洗净后,再用0.01mol·L-1 Na2S2O3溶液润洗,然后装入0.01mol·L-1 Na2S2O3溶液到0刻度以上,排出下端尖嘴内的气泡,调整液面至0刻度或0刻度下某一位置,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+ 2Na2S4O6。试回答下列问答:
(1)步骤①加入的指示剂是_______________________________。
(2)步骤②应使用________式滴定管。
(3)判断达到滴定终点的实验现象是___________________________________。
Ⅱ.(4)若用0.1032 mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是____________。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定时将标准液溅出锥形瓶外
(5)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4 K1=5.9×10-2,K2=6.4×10-5。0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH(选填“大于”、“小于”或“等于”)。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____________。
A.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-)
B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
D.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不能达到目的是( )
A. 除去MgCl2酸性溶液中的Fe3+:加热搅拌,加入MgCO3,过滤,加适量的盐酸
B. 制备Fe(OH)3胶体:向饱和FeCl3溶液中滴加少量NaOH溶液
C. 检验Fe2(SO4)3溶液中是否含有FeSO4:滴加少许酸性高锰酸钾溶液,并振荡
D. 使盛有少量氢氧化镁沉淀的试管中的沉淀溶解:加入一定量的氯化铵溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是( )
A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
D.步骤(2)产物中残留的丙烯醇可用溴水检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
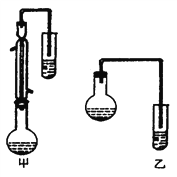
I.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g 苯甲酸和20 mL 甲醇(密度约0.79g · mL-1) ,再小心加入3 mL 浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是_________;若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:__________________。
(2)甲和乙两位同学分别设计了如上图两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用_________装置(填“甲”或“乙”)。理由是___________________。
(3)反应物CH3 OH 应过量,理由是__________________________________。
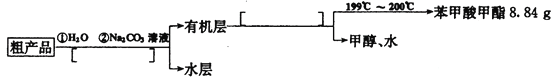
II.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现按下列流程图进行精制,请在流程图中方括号内填入恰当操作方法的名称______________。
(5)通过计算,苯甲酸甲酯的产率为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电导法测定某浓度醋酸电离的ΔH、Ka随温度变化曲线关系如图。已知整个电离过程包括氢键断裂、醋酸分子解离、离子水合。下列有关说法不正确的是
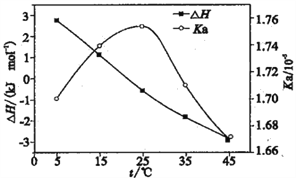
A. 理论上ΔH=0时,Ka最大
B. 25℃时,[CH3COOH]最大
C. 电离的热效应较小是因为分子解离吸收的能量与离子水合放出的能量相当
D. CH3COOH溶液中存在氢键是ΔH随温度升高而减小的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 将 Cl2 通入水中: Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向 Fe2(SO4)3 溶液中加入过量铁粉: Fe3++Fe=2Fe2+
C. 将 SO2 通入双氧水中: SO2+H2O2=2H++SO42-
D. 向 Na2SiO3 溶液中滴加稀盐酸: Na2SiO3+2H+=H2SiO3↓+2Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com