
| A、密封保存的46g NO2气体含有的分子数为NA |
| B、0.1mol/L 碳酸钠溶液中阴离子总数大于0.1NA |
| C、标准状况下,22.4L HF中含有的氟原子数目为NA |
| D、常温常压下,7.1g Cl2与足量的Fe充分反应,转移的电子数目为0.2NA |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L0.1mol?L-1乙酸溶液中H+数为0.1NA |
| B、标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| C、室温下,21.0g乙烯和丙烯的混合气体中含有的碳原子数目为1.5NA |
| D、22.4L的CO气体与lmol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中子数为14的硅原子:1428Si |
B、CH4分子的比例模型 |
C、聚乙烯的结构简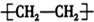 |
| D、次氯酸分子的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、只有① |
| C、只有④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如右图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.
如右图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HSO3-+H2O═H3O++SO32- |
| B、HCO3-+H3O+═CO2↑+2H2O |
| C、S2-+H2O═HS-+OH- |
| D、NH4++H2O═NH3?H2O+H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com