
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n (H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)=____________mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=____________mol。
(3)温度升至800℃,上述反应平衡常数为0.64,则正反应为__________反应(填“放热”或“吸热”)。
(4)700℃时,向容积2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应v(正)______v(逆)(填“>”、“<”或“=”)。
(5)若该容器体积不变,能判断反应达到平衡的是_______________。
①c(CO)与c(H2)的比值保持不变;②v(CO2)正=v(H2O)逆;③体系的压强不再发生变化;④混合气体的密度不变;⑤体系的温度不再发生变化;⑥气体的平均相对分子质量不变
【答案】![]() 0.40 放热 > ①②⑤
0.40 放热 > ①②⑤
【解析】
⑴反应在t1min内水的物质的量改变量为0.4mol,则氢气增加量为0.4 mol,再计算速率。
⑵先计算原反应的平衡常数,再根据已知条件假设转化量再根据平衡常数进行计算。
⑶温度升至800℃,上述反应平衡常数为0.64,平衡常数减小,平衡逆向移动,说明逆向是吸热反应,正向为放热反应。
⑷根据此时的浓度商与K比较判断反应正逆反应速率大小。
⑸①c(CO)与c(H2)的比值保持不变,能判断反应达到平衡,故①符合题意;②v(CO2)正=v(H2O)逆,一正一逆,速率相等,能判断反应达到平衡,故②符合题意;③该反应是等体积反应,体系的压强始终不改变,不能判断反应达到平衡,故③不符合题意;④气体质量不变,容器体积不变,密度始终不变,不能判断反应达到平衡,故④不符合题意;⑤该反应是放热反应,温度会升高,当体系的温度不再发生变化则达到平衡,故⑤符合题意;⑥气体的平均相对分子质量不变,气体质量,物质的量都没有改变,相对分子质量不变,不能判断反应达到平衡,故⑥不符合题意。
⑴反应在t1min内水的物质的量改变量为0.4mol,则氢气增加量为0.4 mol,因此平均速率为![]() ,故答案为:
,故答案为:![]() 。
。
⑵
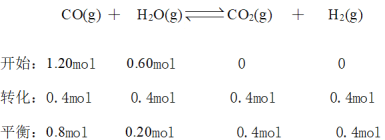
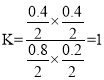 ,
,
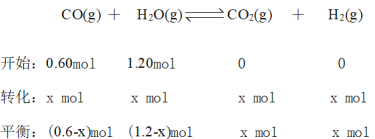
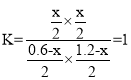 ,解得x = 0.4,故答案为:0.4。
,解得x = 0.4,故答案为:0.4。
⑶温度升至800℃,上述反应平衡常数为0.64,平衡常数减小,平衡逆向移动,说明逆向是吸热反应,正向为放热反应,故答案为:放热。
⑷700℃时,向容积2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,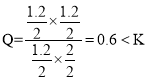 ,则此时该反应v(正)> v(逆),故答案为:>。
,则此时该反应v(正)> v(逆),故答案为:>。
⑸①c(CO)与c(H2)的比值保持不变,能判断反应达到平衡,故①符合题意;②v(CO2)正=v(H2O)逆,一正一逆,速率相等,能判断反应达到平衡,故②符合题意;③该反应是等体积反应,体系的压强始终不改变,不能判断反应达到平衡,故③不符合题意;④气体质量不变,容器体积不变,密度始终不变,不能判断反应达到平衡,故④不符合题意;⑤该反应是放热反应,温度会升高,当体系的温度不再发生变化则达到平衡,故⑤符合题意;⑥气体的平均相对分子质量不变,气体质量,物质的量都没有改变,相对分子质量不变,不能判断反应达到平衡,故⑥不符合题意;综上所述,答案为①②⑤。


科目:高中化学 来源: 题型:
【题目】将![]() 转变为
转变为![]() 的方法为( )
的方法为( )
A.与足量的NaOH溶液共热后,再通入CO2
B.溶液加热,通入足量的HCl
C.与稀H2SO4共热后,加入足量的Na2CO3
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将体积均为5 mL的甲、乙、丙三种液体依次沿试管壁缓缓滴入试管中(勿振荡),出现如图所示的实验现象,则甲、乙、丙的组合可能是( )
![]()
选项 | A | B | C | D |
甲 | 1,2二溴乙烷 | 溴苯 | 水 | 乙醇 |
乙 | 水 | 液溴 | 大豆油 | 乙酸 |
丙 | 苯 | 乙醇 | 溴水 | 乙酸乙酯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的化工原料,以丙烯为原料合成有机玻璃和油墨材料DAP-A树脂的流程如下:

回答问题:
(1)写出下列物质可能的结构简式:B___________________,F________________________。
(2)写出反应类型:反应②___________________;反应③____________________________。
(3)1 mol DAP-A树脂在一定条件下与H2发生加成反应,最多消耗H2_______________mol。
(4)写出反应①的化学方程式_____________________________________________________。
(5)写出G在一定条件下与乙二醇发生反应生成一种高分子化合物的化学方程式为_______。
(6)E的同分异构体中,属于酯类的链状有机物有HCOOCH2CH=CH2、HCOOCH=CHCH3、___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA溶液,溶液pH的变化曲线如图所下列说法不正确的是
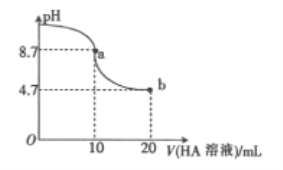
A. a点所示溶液中:c(A-)>c(Na+)>c(OH-)>c(H+)
B. a点所示溶液中:c(Na+)=0.05mol/L
C. pH=7时,c(Na+)=c(A-)
D. b点所示溶液中:c(Na+)<c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+NH4+
B.向NaHCO3溶液中加入醋酸:HCO3-+CH3COOH =CO2↑+H2O+CH3COO-
C.乙醛与新制的碱性氢氧化铜悬浊液加热反应:CH3CHO+2Cu(OH)2+2OH-![]() CH3COO-+2CuO↓+3H2O
CH3COO-+2CuO↓+3H2O
D.苯酚浊液中滴加碳酸钠溶液:2![]() +Na2CO3 =2
+Na2CO3 =2![]() +CO2 +H2O
+CO2 +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验,其中不合理的是

A.用CCl4萃取碘水中的碘B.用NaOH溶液除去溴苯中的溴
C.用水除去硬脂酸钠中的甘油D.用饱和Na2CO3溶液除去乙酸乙酯中的乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在工农业生产中有着重要作用.回答下列问题
(1)工业制硫酸,接触室中发生反应的化学方程式为___________。下列可提高SO2平衡转化率的措施是___________。(填标号)
A.降低温度 B.减小压强 C.延长反应时间 D.增大O2的投料
(2)工业上可用Fe2(SO4)3溶液吸收SO2,该过程的离子方程式为________。为实现吸收液的再生,可通入_________。
(3)用如图装置脱除废烟气中的SO2和废水中的Cu2+,该方法总反应的化学方程式为___________。含Cu2+的废水应置于___________室(填“a”或“b”)。
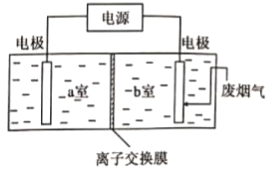
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少 CO 对大气的污染,某研究性学习小组拟研究 CO 和 H2O 反应转化为绿色能源H2。已知:
2CO(g)+O2(g) =2CO2(g); H=-566kJ·moL-1
2H2(g)+O2(g) =2H2O(g); H=-483.6kJ·moL-1
H2O(g) =H2O(l); H=-44.0kJ·moL-1
(1)表示氢气燃烧热的化学方程式中 △H=__________。
(2)写出CO和 H2O(g)作用生成 CO2 和 H2 的热化学方程式____________________________________________。
(3)往 1L 体积不变的容器中加入 0.200mol CO 和 1.00mol H2O(g),在 t℃时反应并达到平衡,若该反应的化学平衡常数 K=1(方程式中各物质前化学计量数为最简比),则 t℃时 CO 的转化率为____;反应达到平衡后,升高温度,此时平衡常数将__________ (填“变大”、 “不变”或“变小”),平衡将向__________ (填“正”或“逆”)方向移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com