
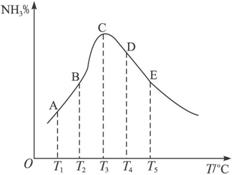
A.B点的正反应速率大于逆反应速率 B.D点容器中的分子总数最少
C.E点和B点的反应速率不相等 D.此可逆反应正反应是放热反应
解析:根据该反应为放热反应,所以在反应未达到平衡以前,即使升高温度,由于正反应速率大于逆反应速率,NH3%始终呈增大趋势。而反应到达平衡以后,随着温度的升高,平衡逆向移动,NH3%开始减小。故C点一定是反应的平衡状态。A选项,因为A、B点时反应没有达到平衡状态,所以正反应速率一定大于逆反应速率,故正确。B选项,因C点达到平衡状态,所以从C到E升高温度,NH3%逐渐减小,所以气体中分子数逐渐增多,即该反应正方向是气体分子数减小。在5个点中E点分子数最大,所以不正确。C选项,E点和B点的反应温度不同,各物质的浓度也不相同,所以速率不相同,故正确。D项,从C点到E点,NH3%逐渐减小,说明升高温度平衡向逆反应方向移动,所以正反应方向是放热反应,故正确。
答案:B


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| ||
| ||
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| 容 器 | 甲 | 乙 |
| 反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源:2013届福建省南安一中高三上学期期末考试化学试卷(带解析) 题型:实验题
(10分)研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义。某学习小组查阅资料并进行相关探究,请帮忙完成以下探究。
(1)pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图。请回答下列问题:(若离子浓度小于10-5mol/L,可认为该离子不存在)
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存。
②H2CO3一级电离平衡常数的数值Ka1 。
。
③人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)可以抵消少量酸或碱,维持pH 7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。
7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。
| A.变大 | B.变小 | C.基本不变 | D.无法判断 |

 CH3OH(g) +H2O(g) △H ;
CH3OH(g) +H2O(g) △H ;
| 容 器 | 甲 | 乙 |
| 反应物 投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
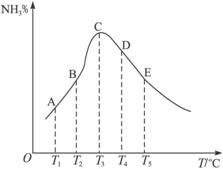
A.B点的正反应速率大于逆反应速率 B.D点容器中的分子总数最少
C.E点和B点的反应速率不相等 D.此可逆反应正反应是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com