
【题目】为确定由硝酸银和硝酸钠组成的混合物中硝酸银的含量,实验室可采用多种方法测定。现取两份不同质量的该混合物进行如下实验:
I.方法一:采用“佛尔哈德法”测定。“佛尔哈德法”可用于测定含银离子的硝酸溶液中银离子的含量,该方法是以铁铵钒[FeNH4(SO4)2·12H2O]为指示剂,NH4SCN溶液为标准溶液。从滴定开始到滴定终点,溶液中发生的主要反应有:
①Ag+(aq)+SCN-(aq)=AgSCN(s)(白色)
②Fe3++SCN-=Fe(SCN)2+(红色)
取14.0 g该混合物溶于蒸馏水配成500 mL待测溶液。取出25.00 mL待测溶液置于锥形瓶中,加入硝酸酸化,然后加水稀释至50 mL滴入指示剂铁铵钒溶液,用0.1000 mol·L-1的NH4SCN标准溶液滴定,消耗标准溶液35.00 mL。
(1)该滴定不能在中性或碱性条件下进行是因为Fe3+会转化为_________(填化学式,下同),Ag+会转化为___________。
(2)当滴入25.00 mL标准溶液时,锥形瓶中_________(填“有”或“没有”)沉淀生成。
(3)滴定终点溶液颜色的变化为________。
(4)称量混合物时,砝码生锈(锈迹未脱落)会导致测得的硝酸银的含量________(填“偏高”或“偏低”或“无影响”)。
(5)该混合物中硝酸银的质量分数为___________(保留三位有效数字)。
II.方法二:取m g该混合物溶于水配成500 mL溶液,取出50.00 mL溶液于锥形瓶中加入过量的稀盐酸充分反应,经“一系列操作”可得到纯净干燥的AgCl固体2.87 g。根据要求回答下列问题:
(6)“一系列操作”的具体步骤为__________、低温干燥。
(7)该混合物质量m=____________(保留三位有效数字)。
【答案】Fe(OH)3 Ag2O 有 由无色变为红色且半分钟内不褪色 偏高 85.0% 过滤洗涤 20.0g
【解析】
(1)在中性或碱性条件下进行是因为Fe3+会转化为Fe(OH)3沉淀,Ag+会转化为Ag2O;
(2)根据题目所给信息“消耗标准溶液35.00 mL”可知滴入25.00 mL标准溶液时Ag+还未完全沉淀;
(3)“佛尔哈德法”的原理是当银离子完成转化成沉淀时,再继续滴加NH4SCN标准溶液,会与Fe3+反应,使溶液变红;
(4)砝码生锈后实际质量会比砝码所标质量高,即混合物的实际质量会比天平所称质量要大,故硝酸银的质量分数会偏高;
(5)各物质的数量关系为![]() ,根据消耗的n(NH4SCN)可以计算出n(AgNO3),m(AgNO3),进而计算出质量分数;
,根据消耗的n(NH4SCN)可以计算出n(AgNO3),m(AgNO3),进而计算出质量分数;
(6)方法二的原理是将银离子转化为AgCl沉淀,称量沉淀的质量来确定硝酸银的质量;
(7)根据AgCl的物质的量n可以得出 50mL溶液中的硝酸银的物质的量也为n,进而计算出混合物中硝酸银的物质的量n,质量m,由第(5)问可知硝酸银的质量分数为85.0%,可以计算出混合物的质量。
(1)在中性或碱性条件下进行是因为Fe3+会转化为Fe(OH)3沉淀,Ag+会转化为Ag2O;故答案为:Fe(OH)3;Ag2O;
(2)根据题目所给信息“消耗标准溶液35.00 mL”可知滴入25.00 mL标准溶液时Ag+还未完全沉淀,故答案为:有;
(3)“佛尔哈德法”的原理是当银离子完成转化成沉淀时,再继续滴加NH4SCN标准溶液,会与Fe3+反应,使溶液变红,故答案为:由无色变为红色且半分钟内不褪色;
(4)用天平称量物品时,物品质量=砝码质量+游码质量,砝码生锈后实际质量会比砝码所标质量高,即混合物的实际质量会比天平所称质量要大,故硝酸银的质量分数会偏高,故答案为:偏高;
(5)各物质的数量关系为![]() ,消耗的NH4SCN溶液的体积为35mL,故n(NH4SCN)= 35mL×0.1000 mol·L-1=0.0035mol,故25.00 mL待测溶液中n(AgNO3)=0.0035mol,所以硝酸银的总物质的量为n=0.0035×20=0.07mol,质量为m=nM=0.07×170=11.9g,质量分数为
,消耗的NH4SCN溶液的体积为35mL,故n(NH4SCN)= 35mL×0.1000 mol·L-1=0.0035mol,故25.00 mL待测溶液中n(AgNO3)=0.0035mol,所以硝酸银的总物质的量为n=0.0035×20=0.07mol,质量为m=nM=0.07×170=11.9g,质量分数为![]() ×100%=85.0%,故答案为:85.0%;
×100%=85.0%,故答案为:85.0%;
(6)方法二的原理是将银离子转化为AgCl沉淀,称量沉淀的质量来确定硝酸银的质量,故一系列操作为:过滤洗涤;
(7)所得AgCl的物质的量n= ![]() =
=![]() =0.01mol,所以50mL溶液中的故硝酸银的物质的量也为0.01mol,混合物中硝酸银的物质的量n=0.01×10=0.1mol,质量m=0.1×170=17g,由第(5)问可知硝酸银的质量分数为85.0%,所以混合物的质量m=
=0.01mol,所以50mL溶液中的故硝酸银的物质的量也为0.01mol,混合物中硝酸银的物质的量n=0.01×10=0.1mol,质量m=0.1×170=17g,由第(5)问可知硝酸银的质量分数为85.0%,所以混合物的质量m=![]() =20.0g;故答案为:20.0g。
=20.0g;故答案为:20.0g。


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法不正确的是( )
A.在离子晶体中,正、负离子半径比(![]() )越大,晶体的配位数越大
)越大,晶体的配位数越大
B.CaF2晶体中,Ca2+配位数为8,F-配位数为4,阴、阳离子配位数不相等主要是由于F-、Ca2+电荷(绝对值)不相同
C.MgO的熔点比MgCl2的高主要是因为MgO中的离子键比MgCl2中的离子键强
D.金属晶体和离子晶体都能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式书写正确的是
A.往稀盐酸中逐滴加入Na2CO3溶液,开始时:H++CO![]() =HCO
=HCO![]()
B.草酸(H2C2O4,弱酸)溶液中加入酸性KMnO4溶液: 2MnO![]() +5C2O
+5C2O![]() +16H+=2Mn2++10CO2↑+8H2O
+16H+=2Mn2++10CO2↑+8H2O
C.往少量澄清石灰水中加入Ca(HCO3)2溶液: Ca2++OH-+HCO![]() =CaCO3↓+H2O
=CaCO3↓+H2O
D.用HI溶液溶解Fe2O3固体:Fe2O3+6H+=2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的单质和常见的化合物在工、农业生产中用途广泛。
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
N2 | O2 | Ar | CO2 |
-196℃ | -183℃ | -186℃ | -78℃ |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是______.
(2)雷雨时空气中的N2转化为NO,生成物NO是______色的气体,______(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应,写出NO2与水反应的化学方程式为__________________.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气;
①制取氨气的化学方程式为__________________;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为______g;
(4)已知:4NH3+6NO![]() 5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能;
5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能; ![]()
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同);
①NH3与稀硫酸溶液反应的离子方程式为__________________;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对如图所示乙醇分子结构,下述关于乙醇在各种化学反应中化学键断裂情况的说法不正确的( )
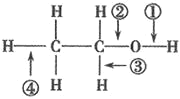
A.与金属钠反应时,①键断裂
B.与浓硫酸共热至170℃时,②、④键断裂
C.在 Ag 催化下与O2反应时,①、③键断裂
D.与醋酸、浓硫酸共热时,②键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由有机物 a 制备有机物 d 的合成路线如图所示。下列说法正确的是( )
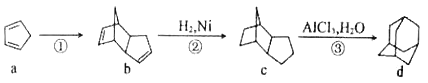
A.a 中的所有原子处于同一平面
B.b 的分子式为C10H12,是乙烯的同系物
C.a 的一氯代物有 3 种,d 的一氯代物有 4 种
D.a、b 均可与酸性高锰酸钾溶液反应,c 与 d 互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A. 漂白粉溶液在空气中失效:ClO-+CO2+H2O==HClO+HCO3-
B. 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-==Mn2++Cl2↑+2H2O
C. 向澄清的石灰水中通入过量的CO2:CO2 + OH- == HCO3-
D. 在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)写出下列元素的名称:A_____,B_____,C_____,D_____。
(2)D元素位于周期表中____周期_____族。D2-的结构示意图是____。
(3)AB2是___(填“共价”或“离子”)化合物,C2B2所含化学键的类型是___、___。写出AB2与C2B2反应的化学方程式:___________________。
(4)用电子式表示化合物C2D的形成过程:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com