
【题目】如图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述错误的是( )注:氨气在水中溶解度(体积比——V水:V气=
1:700,CO2在水中溶解度1:1。

A.A气体是NH3,B气体是CO2
B.侯氏制碱法的工艺流程应用了物质溶解度的差异
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
【答案】D
【解析】
向氨化的饱和食盐水中通入足量二氧化碳气体析出碳酸氢钠,利用CO2+NH3+HO2+NaCl═NaHCO3↓+NH4Cl的反应原理可制备碳酸氢钠,加热分解碳酸氢钠来制备碳酸钠,流程中A为氨气,B为二氧化碳,得到的悬浊液为NaHCO3,晶体为NaHCO3,根据此分析进行解答。
A.氨气易溶于水,二氧化碳能溶于水,依据侯德榜制碱的原理:向氨化的饱和食盐水中通入二氧化碳气体析出碳酸氢钠,加热反应制备纯碱,所以气体A为氨气,B为二氧化碳,故A选项正确。
B.侯氏制碱法利用的是碳酸氢钠溶解度比碳酸钠在同温下小的差异,在氨化饱和的氯化钠溶液里通足量CO2气体得到碳酸氢钠沉淀,故B选项正确。
C.第Ⅲ步操作是过滤操操作,通过过滤得到碳酸氢钠晶体,所以需要的玻璃仪器有:烧杯、漏斗、玻璃棒,故C选项正确。
D.第Ⅳ步操作是将晶体碳酸氢钠直接加热分解得到碳酸钠固体,故D选项错误。
故答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A.BeCl2为V形的极性分子
B.ClO4的空间构型为正四面体形
C.P4和CH4都是正四面体分子且键角都为109°28′
D.H2O和CO32的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PH3是一种无色剧毒气体,其分子结构和NH3相似,但P—H键键能比N—H键键能低。下列判断错误的是
A. PH3沸点低于NH3沸点,因为P—H键键能低
B. PH3分子是极性分子
C. 一个PH3分子中,P原子核外有一个孤电子对
D. PH3分子稳定性低于NH3分子,因为N—H键键能高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净物X、Y、Z转化关系如图所示,下列判断正确的是( )

A. X可能是金属铜 B. Y不可能是氢气
C. Z可能是氯化钠 D. Z可能是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积为2L的恒容密闭容器里充入1 mol N2和4 molH2,在一定温度下发生反应: N2(g)+3H2(g)![]() 2NH3(g);△H<0。10秒后达到平衡,c(NH3)为0.4mol/L。下列说法正确的是
2NH3(g);△H<0。10秒后达到平衡,c(NH3)为0.4mol/L。下列说法正确的是
A. 该反应达平衡时H2的转化率为40%
B. 降低温度能使混合气体的密度增大
C. 向该容器中充入N2,平衡正向移动
D. 研发高效催化剂可大大提高N2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为验证卤素单质氧化性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
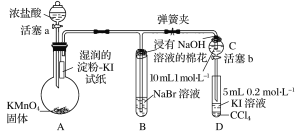
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸,发生反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)盛放浓盐酸的仪器名称为____________________。
(2)在烧瓶内发生反应时,体现浓盐酸的性质为______________________________。
(3)验证氯气的氧化性强于碘的实验现象是_________________________________。
(4)B中溶液发生反应的离子方程式是____________________________________________。
(5)浸有NaOH溶液的棉花的作用为______________________________________________。
(6)为验证溴的氧化性强于碘,过程Ⅳ的操作步骤和现象是__________________________。
(7)过程Ⅲ实验的目的是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成填空。
(1)NaHCO3电离方程式:______________________________________________
(2)过氧化钠与水反应的离子方程式:__________________________________________
(3)配平方程式:______NH4NO3![]() ______ HNO3 +_____ N2↑+______ H2O;在反应中被氧化与被还原的氮原子的个数比为________
______ HNO3 +_____ N2↑+______ H2O;在反应中被氧化与被还原的氮原子的个数比为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠与二氧化碳能生成氧气,在潜水艇中做制氧剂。某学生为了验证这一实验,利用足量的大理石、盐酸和1.95g Na2O2,制取O2。设计出如下图实验装置
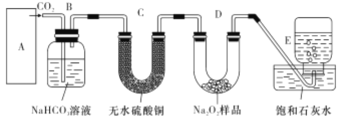
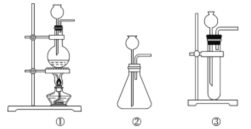
(1)A中制取CO2的图,应选用________(填①或②或③)
写出本题中制取氧气的化学方程式__________________B装置的作用是___________________
(2)若E中的出现少量白色沉淀,说明原因:__________________________________
(3)若D中1.95g Na2O2接近反应完毕时,预测会有何种现象:_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮硫的氧化物是造成大气污染的主要物质。研究它们的反应机理,对于消除环境污染有重要意义。
(1)2NO(g)+O2(g)=2NO2(g)△H的反应机理和各基元反应(基元反应是指在反应中一步直接转化为产物的反应,又称为简单反应)的活化能为:
2NO(g)![]() N2O2(g)E1=82kJ·mol-1v=k1c2(NO)
N2O2(g)E1=82kJ·mol-1v=k1c2(NO)
N2O2(g)![]() 2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)
2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)
N2O2(g)+O2(g)![]() 2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)
2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)
2NO2(g)![]() N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)
N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)
①2NO(g)+O2(g)![]() 2NO2(g)△H=______kJmol-1,平衡常数K与上述反应速率常数k1、k-1、k2、k-2的关系式为K=_______;
2NO2(g)△H=______kJmol-1,平衡常数K与上述反应速率常数k1、k-1、k2、k-2的关系式为K=_______;
②某温度下反应2NO(g)+O2(g)![]() 2NO2(g)的速率常数k=8.8×10-2L2mol-2s-1,当反应物浓度都是0.05molL-1时,反应的速率是__________________molL-1s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,则反应速率增大为之前的______倍。
2NO2(g)的速率常数k=8.8×10-2L2mol-2s-1,当反应物浓度都是0.05molL-1时,反应的速率是__________________molL-1s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,则反应速率增大为之前的______倍。
(2)2SO2(g)+O2(g)![]() 2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2
2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2![]() 2VO2+SO3(快)4VO2+O2
2VO2+SO3(快)4VO2+O2![]() 2V2O5(慢)
2V2O5(慢)
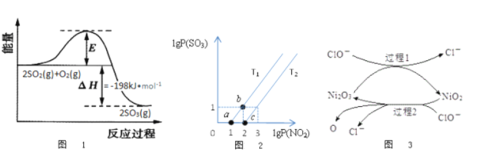
下列说法正确的是___________
A.反应速率主要取决于V2O5的质量
B.VO2是该反应的催化剂
C.逆反应的活化能大于198kJ/mol
D.增大SO2的浓度可显著提高反应速率
(3)某研究小组研究T1℃、T2℃时,氮硫的氧化物的转化:NO2(g)+SO2(g)![]() NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
①根据题意可知:T1______T2(填“>”“<”或者“=”),理由是___________________。
②由平衡状态a到b,改变的条件是__________________。
(4)工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收SO2。为了提高吸收效率,常用Ni2O3作为催化剂。催化过程如图3所示。
①过程2的离子方程式_______________________________。
②Ca(C1O)2也可用于脱硫,且脱硫效果比NaC1O更好,原因是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com