
| A. | 氧化铁可用来制造红色油漆和涂料 | |
| B. | 生铁、普通钢和不锈钢中的含碳量依次减小 | |
| C. | 硅胶可用作实验室和袋装食品、瓶装药品等的干燥剂 | |
| D. | 硅是生产光纤制品的基本原料 |
分析 A.氧化铁颜色为红色;
B.生铁的含碳量是2%-4.3%;钢的含碳量是0.03%-2%;
C.硅胶可用作干燥剂;
D.生产光纤制品的基本原料为二氧化硅.
解答 解:A.氧化铁颜色为红色,可用来制造红色油漆和涂料,故A正确;
B.生铁的含碳量是2%-4.3%;钢的含碳量是0.03%-2%,所以生铁、普通钢和不锈钢中的含碳量依次降低,故B正确;
C.硅胶具有吸附能力,可用作干燥剂,故C正确;
D.生产光纤制品的基本原料为二氧化硅,故D错误.
故选D.
点评 本题综合考查元素化合物知识,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题
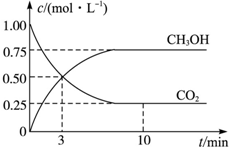 工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.
工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:HI(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 | |
| B. | 已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol,则氢气的燃烧热为△H=-285.8 kJ/mol | |
| C. | 肼(N2H4)是一种用于火箭或燃料电池的原料,已知2H2O(g)+O2(g)=2H2O2(l)△H=+108.3kJ/mol ①N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol ②则有反应:N2H4(l)+2 H2O2(l)=N2(g)+4H2O(l)△H=-642.3kJ/mol | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
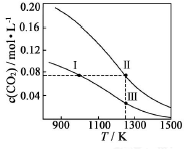 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)>3P总(状态Ⅰ) | |
| C. | 体系中c(CO2):c(CO2,状态Ⅱ)<3c(CO2,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸钠溶液中加醋酸 CO32-+2H+═H2O+CO2↑ | |
| B. | 向稀硫酸溶液中投入铁粉 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 向盐酸中投入碳酸钙 CO32-+2H+═H2O+CO2↑ | |
| D. | 硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 LCO2所含的分子数为0.5NA | |
| B. | 标准状况下,22.4 L 酒精中所含分子数为NA | |
| C. | 标准状况下,18g H2O所含原子数为NA | |
| D. | 常温常压下,48g O2与O3混合物含有的氧原子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com