
����Ŀ���Թ�����(��Ҫ�ɷ�ΪSiO2,����������Fe2O3�� Al2O3) Ϊ�����V2O5-K2SO4�������Ӵ���������Ĵ�����������һ�ַϷ������ۺϻ������õĹ���·�ߡ�

��֪�� �Ϸ������з�Ԫ����Ҫ��VOSO4��V2O5��ʽ����;
V2O5�����������������ˮ������������VO2+,���ڼ�����VO3-;
VOSO4��ǿ����ʣ�����ˮ�����VO2+��
�ش��������⣺
��1��VOSO4��V Ԫ�صĻ��ϼ�Ϊ___________��
��2�����������ܺ���������Լ�X Ϊ_________��
a��NaClO b��Na2SO3c��K2SO3d��K2S
��3������Һ���еõ���ƷK2SO4�IJ���Ϊ_________��������������V2O2(OH)4,������_________��
��4������Һ����c(VO3-)=0.1mol��L-1,Ϊʹ��Ԫ�صij����ʴﵽ98%,����Ӧ����c(NH4+)Ϊ_________[Ksp(NH4VO3)=1.6��10-3]��
��5����������ʱͨ�������Ŀ���,��Ӧ���β������ֱ���ŷš��÷�Ӧ�Ļ�ѧ����ʽΪ____________��
��6�� V2O5���Ȳⶨԭ���� ��ȡV2O5��Ʒag,�ȼ������ὫV2O5ת��ΪVO2+,�ټ���V1 mLc1mol��L-1(NH4) 2Fe(SO4) 2��Һ��VO2+ת ��ΪVO2+,�� �� ��c2mol��L-1KMnO4 ��Һ�ζ�������(NH4)2Fe(SO4)2���յ㣬����KMnO4��ҺV2mL���������ʲ����뷴Ӧ��ʵ����ijV2O5��Ʒ�Ĵ���Ϊ91%,�������ϼ���(NH4)2Fe(SO4)2��Һ�����V1����_________mL (�������ĸ��ʾ)��
���𰸡� +4 c ������Ũ�����ᾧ Al(OH)3��Fe(OH)2 ��Fe(OH)3 0.8 mol��L-1 4NH4VO3+3O2![]() 2V2O5+2N2 +8H2O 10a/c1
2V2O5+2N2 +8H2O 10a/c1
��������������Ҫ������ڷϷ������ۺϻ������õĹ���·�ߵ����ۡ�
��1��VOSO4��VԪ�صĻ��ϼ�Ϊ+4��
��2�����������ܺ����X��VO2+��ԭΪVOSO4�����������Լ�XΪc��a��NaClO����ǿ�����ԣ����������⣻b��Na2SO3������������Na+��c��K2SO3 �������⣻d��K2S�������ʹ���S����ѡc��
��3������Һ���еõ���ƷK2SO4�IJ���Ϊ������Ũ�����ᾧ�������۳�����V2O2(OH)4��������Al(OH)3��Fe(OH)2��Fe(OH)3��
��4������Һ����c(VO3-)=0.1mol��L-1��ʹ��Ԫ�صij����ʴﵽ98%����ʱ��Һ��c(VO3-)=0.002mol��L-1������Ӧ����c(NH4+)=Ksp(NH4VO3)/c(VO3-)=1.6��10-3/0.002mol��L-1=0.8mol��L-1��
��5������ʱ��������Ⱦ����N2��ˮ�������÷�Ӧ�Ļ�ѧ����ʽΪ4NH4VO3+3O2![]() 2V2O5+2N2 +8H2O��
2V2O5+2N2 +8H2O��
��6����Ӧ����ʽ��(NH4)2Fe(SO4)2��VO2+������(NH4)2Fe(SO4)2����ʱc1V1mmol=91%a/182��2mol=10a/c1��V1=10a/c1���������ϼ���(NH4)2Fe(SO4)2��Һ�����V1����Ϊ10a/c1��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ����С���ͬѧ���ʵ���ü��黹ԭ����������ȡ������
��1������ͬѧ�ֱ�������ͼ��ʾװ����ȡSO2 ��CH4��

������M������Ϊ______________��
����Aװ���Ʊ�SO2,����ʹ��ϡ���ᣬ��ԭ����_________________��
����Bװ����ȡ����Ļ�ѧ����ʽΪCH3COONa+NaOH![]() CH4��+Na2CO3,ʵ��ʵ���г��ü�ʯ��(NaOH ��CaO�Ļ����)������NaOH��ԭ����____________________________________��
CH4��+Na2CO3,ʵ��ʵ���г��ü�ʯ��(NaOH ��CaO�Ļ����)������NaOH��ԭ����____________________________________��
��2������ͬѧ���ü����Ƶõ�CH4��SO2����ʵ��,����֤�����г������������CO2��Ϊ������֤,ѡ�ü���ʵ���е�װ��A��B����ͼ��ʾ��װ�ý���ʵ��,����G���е���ɫ��������,C�г���ʯ��ˮ����ǡ�

������ͬѧ��ʵ��װ����,�������ӵĺ���˳��ΪA��B��H��_____�� �� �� �� ��
��Eװ�õ�������________________,Gװ�õ�������_______________��
��Fװ���з�����Ӧ�Ļ�ѧ����ʽΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������÷�Һ©�������һ���ǣ� ��
A.���ͺ�ˮ
B.������Ȼ�̼
C.������Һ����ɳ
D.ˮ�;ƾ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ��Cl��Ũ����С���ǣ� ��
A.200mL 2mol/L MgCl2��ҺB.1000mL 2.5mol/L NaCl��Һ
C.300mL 5mol/L KCl��ҺD.250mL 1mol/L AlCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Һ�п��ܺ���HCl��MgCl2��AlCl3��NH4Cl��Na2CO3��KCl�еļ������ʣ�������Һ����μ���NaOH��Һ���������������ʵ���(n)������NaOH��Һ���(V)�Ĺ�ϵ��ͼ��ʾ���ش��������⣺

��1����Һ��һ�����е�������______________���ѧʽ����
��2����Һ��һ�������е�������____________���ѧʽ����
��3����Һ�п��ܺ��е�������__________�������ƣ����жϸ������Ƿ���ڵ�ʵ�鷽����________��������_____________��
��4���ֱ�д��AB�Ρ�BC�η��������ӷ���ʽ��
��AB��Ϊ________________________________��
��BC��Ϊ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͪ�Ǻϳ�ij�ֿ���ҩ����Ҫ�м��壬��ṹ��ͼ��ʾ�����й��ڰ�����ͪ�����ʵ���������ȷ����

A. ������ͪ�ķ���ʽΪC22H23O8
B. �����к���5������̼ԭ��
C. �÷���һ���������ܷ���ȡ������������ȥ��Ӧ
D. 1 mol�������� NaOH��Һ��Ӧ�����ɷ�Ӧ3 mol NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
��1��������-COOH��������___________________��
��2��(CH3CH2)2C(CH3)2������Ϊ__________________��
��3��2-��-1-��ϩ�ļ���ʽ________________________��
��4����Է���������С���л������ʽ____��
��5�� ���������ŵ�������_____________�����л�����Ӿ۷�Ӧ�����ò���Ľṹ��ʽΪ_________________��
���������ŵ�������_____________�����л�����Ӿ۷�Ӧ�����ò���Ľṹ��ʽΪ_________________��
��6��3-�������һ�ȴ�������_________�֣������������칹����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β��(�������ࡢCO��SO2��NO������)�dz��п�������ȾԴ�������ķ���֮һ������������������װһ������ת������(�ò��ٺϽ�������)�������ص���ʹCO��NO��Ӧ�����ɿɲ��������̬����ѭ���������壬����ʹ������ȼ�ռ�SO2ת����
(1)д��һ����̼��һ��������Ӧ�Ļ�ѧ����ʽ___________��
(2)����ת��������ȱ������һ���̶�����߿�������ȣ���ԭ����___________��
(3)���Ƴ��п�����ȾԴ�ķ���������_______��
A.��������Դ B.ʹ�õ綯�� C.ֲ������ D.���Ϻ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����KOH��Ca��OH��2�Ļ����Һ��c��OH����=0.1 molL��1��ȡ����Һ500 mL��������ͨ��CO2��ͨ��CO2�������V�������ɳ��������ʵ�����n���Ĺ�ϵ��ͼ��ʾ��ͼ�У�V1��Ϊ112 mL����״��������ͼ��V2��V3���������λΪmL���ֱ��ǣ� ��
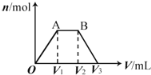
A. 560��672 B. 1008��1120 C. 2240��2352 D. 392��504
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com