
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:
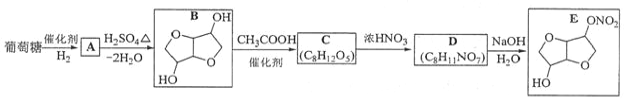
回答下列问题:
(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为_____________。
(4)C的结构简式为________________________。
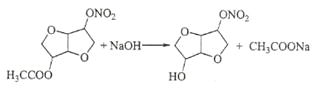
(5)由D到E的反应方程式为_____________________________________________。
(6)F是B的同分异构体,7.30 g的F足量饱和碳酸氢钠可释放出2.24 L二氧化碳(标准状况),F的的一种同分异构体核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为____________________________。
【答案】C6H12O6 羟基取代反应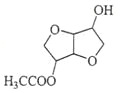
![]()
【解析】
葡萄糖在催化剂作用下与氢气发生醛基的加成反应生成A,A在浓硫酸的作用下发生分子内脱水生成B,B与乙酸发生酯化反应生成C,根据C与D的分子式可知,C生成D是C分子中一个羟基与硝酸发生取代反应,D在氢氧化钠溶液中水解成E。
(1)葡萄糖的分子式为C6H12O6;
(2)葡萄糖在催化剂作用下与氢气发生醛基的发生加成反应生成A,因此A中含有的官能团的名称为羟基;
(3)B与乙酸发生酯化反应生成C,由B到C的反应类型为酯化反应或取代反应;
(4)根据B的结构简式可知C的结构简式为: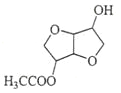 ;
;
(5)由D到E是乙酸形成的酯基水解,反应方程式为: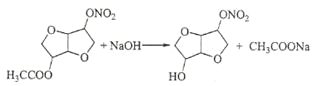 ;
;
(6)F是B的同分异构体,7.30 g的F足量饱和碳酸氢钠可释放出2.24 L二氧化碳(标准状况),说明F分子中含有羧基,7.30 g的F的物质的量为7.30 g÷146g/L=0.05mol,2.24 L二氧化碳(标准状况)的物质的量是0.1mol,因此F分子中含有两个羧基,则F相当于丁烷分子中2个氢原子被羧基取代,F的的一种同分异构体核磁共振氢谱为三组峰,峰面积比为3∶1∶1,说明F中含有三种不同的氢,并且个数比为3∶1∶1,因此F的结构简式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】在无色透明的强酸性溶液中,能大量共存的离子组是
A.K+、Na+、NO3-、HCO3-B.K+,Cu2+、Na+、Cl-
C.Na+、Mg2+、NO3-、SO42-D.Ag+、Na+、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁及其化合物的说法中正确的是( )
A.铁与水蒸气在高温下的反应产物为Fe2O3和H2
B.氢氧化亚铁是红褐色沉淀
C.Fe3+与KSCN溶液产生红色沉淀
D.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂电池的构造如图所示,电池内部“→”表示放电时Li+的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC6 ![]() LiCoO2+6C,下列说法错误的是( )
LiCoO2+6C,下列说法错误的是( )

A. 该电池的负极为LiCoO2
B. 充电时Li+向C电极电极移动
C. 充电时的阴极反应:Li1-xCoO2+xLi++xe-===LiCoO2
D. 外电路上的“→”表示放电时的电子流向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里做钠跟水反应的实验时,用到的仪器和药品是( )
①试管 ②镊子 ③小刀 ④滤纸 ⑤研钵 ⑥烧杯 ⑦坩埚 ⑧石棉网 ⑨玻璃片 ⑩药匙
A. ①②③④ B. ②③④⑥⑨ C. ③④⑧⑨⑩ D. ②⑤⑦⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(1)反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2_______p 1(填“>”或“<”),得出该结论的理由是________________。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+![]() S↓+2I2+2H2O
S↓+2I2+2H2O
ii.I2+2H2O+_________![]() _________+_______+2 I-
_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是 ( )
A. 溶液中的Na+浓度增大,有O2放出
B. 溶液中的OH-浓度不变,有H2放出
C. 溶液中的Na+数目减小,有O2放出
D. 溶液中OH-的浓度增大,有O2放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠广泛用于印染漂白、食品等行业,常作媒染剂、漂白剂、食品添加剂等。某兴趣小组用下列装證制备NaNO2。
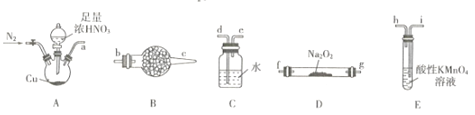
已知:①2NO+Na2O2=2NaNO2; ②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。
请回答下列问题:
(1)利用上图中的装置制备NaNO2,其连接顺序为a→__________(按气流方向,用小写字母表示)。
(2)实验开始时,先通一段时间N2的目的是__________。
(3)装置B中盛放试剂的名称为____,装置C的作用是_______。
(4)装置E中发生反应的离子方程式为_____________。
(5)为测定亚硝酸钠的含量,称取3.000g样品溶于水配成500mL.溶液,量取25.00mL溶液于锥形瓶中,硫酸酸化后加入过量KI,发生反应:2NO2-+2I-+4H+=2NO↑+I2+2H2O(杂质不参与反应)。然后用0.1000mol/LNa2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32-=S4O62-+2I-),消耗20.00mL。
①该实验可选用的指示剂为_____,达到滴定终点时的现象是__________。
②所得样品中亚硝酸钠的质量分数为____________。
③下列操作会导致测定结果偏高的是_______(填代号)。
a.滴定过程中向锥形瓶中加少量水
b.消定前滴定管尖嘴部分有气泡,滴定后气泡消失
c.读数时,滴定前仰视,滴定后府视
d.滴定时,标准被滴到锥形瓶外
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com