
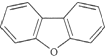
 ,其一氯代物有( )
,其一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
科目:高中化学 来源: 题型:选择题
| A. | 原子中核内质子数和核外电子数一定相等 | |
| B. | 中和反应中参加反应的酸和碱质量一定相等 | |
| C. | 溶液稀释前后溶质的质量一定相等 | |
| D. | 物质发生化学变化前后,质量总和一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| D. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$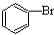 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的电子式: | |
| B. | 聚氯乙烯的结构简式: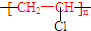 | |
| C. | 硫离子的结构示意图: | |
| D. | 碳酸氢铵的电离方程式:NH4HCO3=NH4++H++CO32ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl 加聚反应 | |
| B. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O 酯化反应 | |
| C. | 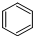 +Br2 $\stackrel{FeBr_{3}}{→}$ +Br2 $\stackrel{FeBr_{3}}{→}$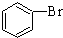 +HBr 加成反应 +HBr 加成反应 | |
| D. | 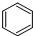 +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$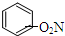 +H2O 取代反应 +H2O 取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,O.1 mol•L-1HF溶液pH=l,Ksp(CaF2)随温度和浓度的变化而变化 | |
| B. | 向1L0.2 mol•L-1HF溶液中加入1L O.2 mol•L-1CaCl2溶液,没有沉淀产生 | |
| C. | AgCl不溶于水,不能转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是周期表中前 四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前 四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.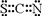 ]-,其中心原子采用sp杂化.
]-,其中心原子采用sp杂化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molNa2O2中含有的离子总数为4 NA | |
| B. | 0.1 mol羟基(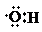 )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| C. | 室温下,1 L pH=13的NaOH溶液中,水电离出的OH-的数目为0.1 NA | |
| D. | 在5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中,生成28 g N2时转移的电子数目为3.75 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用于自来水的消毒净化 | |
| B. | Fe2 O3可用作红色油漆和涂料 | |
| C. | 酚醛树脂可用作绝缘、隔热和复合材料 | |
| D. | 硫酸可用于精炼石油以及制取多种挥发性酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com