
����ͼʾ���Ӧ������������ǣ�������
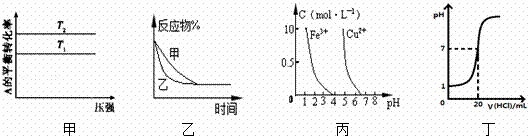
| �� | A�� | ͼ�����жϳ���ӦA��g��+B��g��⇌��2C��g���ġ�H��0��T2��T1 |
| �� | B�� | ͼ�ұ�ʾѹǿ�Կ��淴Ӧ2A��g��+2B��g��⇌3C��g��+D��s����Ӱ�죮�ҵ�ѹǿ�ȼ�ѹǿ�� |
| �� | C�� | ����ͼ��������ȥCuSO4��Һ�е�Fe3+��������Һ�м�������CuO������pH��4 |
| �� | D�� | ͼ����ʾ25��ʱ����0.1 mol/L������ζ�20 mL 0.1 mol/L NaOH��Һ����Һ��pH�������������ı仯 |
| ��ѧƽ���Ӱ�����أ�pH�ļ��㣻���ܵ���ʵ��ܽ�ƽ�⼰����ת���ı��ʣ� | |
| ר�⣺ | ����������������ۣ� |
| ������ | A�������¶ȣ���ѧƽ���������ȷ�����У� B������ѹǿ����ѧƽ���������������С�ķ�����У� C������ȥCuSO4��Һ�е�Fe3+������������Ҫ��pH��Χ�������ӳ�����ȫ������ͭ���ӿ�ʼ������ D�����ݵζ���ʼ֮ǰ��0.1 mol/L NaOH��Һ��pH���жϼ��ɣ� |
| ��� | �⣺A�������¶ȣ���ѧƽ��A��g��+B��g��⇌2C��g����H��0�������ȷ�����У��������淴Ӧ������У�A��ת����ԽС������A��ת����ԽС���¶�Խ�ߣ�T2��T1����A���� B������ѹǿ�����淴Ӧ2A��g��+2B��g��⇌3C��g��+D��s���������������С�ķ�����У�����������Ӧ������У���Ӧ��İٷֺ���Ҫ��С�����ҵ�ѹǿ�ȼ�ѹǿС����B���� C������ȥCuSO4��Һ�е�Fe3+������������Ҫ��pH��Χ�������ӳ�����ȫ������ͭ���ӿ�ʼ������Ϊ�������������ӣ�������Һ�м�������CuO��������pH��4����C��ȷ�� D���ζ���ʼ֮ǰ��0.1 mol/L NaOH��Һ��pH=13������1����D���� ��ѡC�� |
| ������ | ���⿼��ѧ����ѧƽ���ƶ���Ӱ�����أ����ͼ���������������Ѷȣ�ע��֪ʶ��Ǩ�ƺ�Ӧ���ǹؼ����ѶȲ��� |


 �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�±��������Ԫ�����ڱ���һ����Ԫ�أ��ش��������⣺
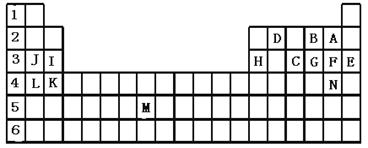 |
��1����������ĸ�����15��Ԫ���У���ѧ��������õ��� ����Ԫ�ط��ű�ʾ����ͬ������������ǿ���� ���ǽ�������ǿ���� �������µ���ΪҺ̬�ķǽ���Ԫ���� �����ڹ���Ԫ�ص��� ���ÿ�����ĸ��ʾ����
��2��B��F��C��̬�⻯��Ļ�ѧʽ�ֱ�Ϊ �� �� �������� ��ȶ���
��3������������ԭ�Ӱ뾶��С���� (ϡ������Ԫ�س��⣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Li��Na��K��Rb��Cs����������ȷ��һ����
�ٽ�������ǿ�����
�����ǵ������ﶼֻ��M2O��M2O2������ʽ
������Ȼ���о��Ի���̬��ʽ����
���ܶȰ�Li��Cs˳�����ε���
�����Ӱ뾶��Rb+>K+>Na+
A���٢ڢ� B���٢ۢܢ� C���ڢܢ� D���٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ����ᡢ����������أ�����˵����ȷ���ǣ�������
�� A�� ���ײ���ֱ��һ���ڼ�������ʮ���ף�1nm=10﹣9m��֮�䣬������ײ������ڽ���
�� B�� ��ͭ���ҹ�ʹ������ĺϽ�
�� C�� SiO2�ƳɵIJ�����ά�����ڵ�������ǿ������������ͨѶ����
�� D�� ������Ư�۶���ˮ����ҩƷ��ԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з�Ӧ���õ���Һ��һ��ֻ��һ�����ʵ��ǣ�������
| �� | A�� | �������ữ��Fe2��SO4��3��Һ�м��������Ba��OH��2��Һ |
| �� | B�� | ��AlCl3��Һ�м�������İ�ˮ |
| �� | C�� | ��NaOH��Һ��ͨ��CO2���� |
| �� | D�� | ��������Cu�ۼ���FeCl3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ס��ҡ�������4�����ʷֱ�2�ֻ�3��Ԫ�أ����ǵķ����и���18�����ӣ�������̬�⻯���ˮ�зֲ���������������ӣ������ƶϺ������ǣ�������
| �� | A�� | ij������Һ��������������ӣ������Һ�Լ��ԣ�ֻ�����ᷴӦ |
| �� | B�� | ����������Ħ��������ͬ������һ�����м��Լ��ͷǼ��Լ� |
| �� | C�� | ���к��ж�����IVA���Ԫ�أ����һ���Ǽ����ͬϵ�� |
| �� | D�� | ���ͼ��и�Ԫ����������ͬ������һ������﹣1�۵�Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Դ�뻷������Խ��Խ�����ǹ�ע��̼һ��ѧ��Ϊ�о����ȵ㣮��̼һ��ѧ�����Ե���̼��CO��CO2��CH4��CH3OH�Ⱥ�һ��̼ԭ�ӵ�����Ϊԭ�Ϻϳɹ�ҵ��Ʒ�Ļ�ѧ�빤�գ�
���Ȼ�ѧ����ʽΪ��CO2��g��+3H2��g��⇌CH3OH��g��+H2O��g����H=﹣49.0kJ/mol�����¶Ⱥ��ݻ���ͬ��A��B��C���������У����������Ϊ2L��������ͬ��ʽͶ�뷴Ӧ����ֺ��º��ݣ���10���Ӻ�ﵽƽ�⣬�ﵽƽ��ʱ���й��������±���
| ���� | A | B | C |
| ��Ӧ��Ͷ���� | 1molCO2��g���� 3molH2��g�� | 1molCH3OH��g���� 1molH2O��g�� | 2molCO2��g����6mol H2��g�� |
| CH3OH��g��Ũ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�����仯 | �ų�29.4kJ | ����a kJ | �ų�b kJ |
�ٴӷ�Ӧ��ʼ����ƽ��ʱ��A����CO2����ʾ��ƽ����Ӧ����Ϊ��0.03��mol/��L•s�����þ�����ֵ��ʾ��
��a=��19.6����c1��=��c2������1/2c3���������������=������
��CO�����ںϳɼ״�����ѹǿ0.1MPa�����£������ΪbL���ܱ������г���amolCO��2amolH2���ڴ��������ºϳɼ״���CO��g��+2H2��g��⇌CH3OH��g����ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ1��ʾ

��1���÷�Ӧ���ڷ�Ӧ�����ȡ�������ȡ����ȡ�����P2������0.1MPa���������������=����
��2��100��ʱ���÷�Ӧ��ƽ�ⳣ��K=��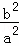 �����ú�a��b�Ĵ���ʽ��ʾ��
�����ú�a��b�Ĵ���ʽ��ʾ��
��̼һ����������������β������Ҳ���п�Ϊ����CO��CH4����һ�������¾������뵪��������������Ⱦ�����ʣ�CO��NO�ڴ����������·�Ӧ���£�2NO��g��+2CO��g��⇌2CO2��g��+N2��g����H��0���ھ��ȡ����ݵ��ܱ������м���һ������NO��CO����������Ӧ��ͼ2��ʾ��ͼ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬���ǡ�c��������ĸ��ţ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������鶼����Ҫ���⻯���Ҫ��ش��������⣺
��1��NH3��g����O2��g����Ӧ����NO��g����H2O��g���ġ�H��������ֱ�Ӳ������Ӳ����ȶ��Կ�������Ҫԭ����������
��֪��1molN2��g����Ӧ����2mol NH3��g���ġ�H=��92kJ•mol��1��1mol H2��g��ȼ������H2O ��g�� �ġ�H=��242kJ•mol��1��1mol N2��g����O2 ��g����ȫ��Ӧ����NO��g���ġ�H=+180kJ•mol��1������17g ��������������ȫ����һ�����������ˮ�������ų�������Ϊ������
��2��������ˮ����ͨ��۽�̫���ܷ�Ӧ�����ɷ�����Ӧ�Ļ�ѧ����ʽΪCH4+H2O⇌CO+3H2���÷�ӦΪ���ȷ�Ӧ����֪�����ֲ�ͬ���������£������IJ�����ʱ��ı仯��ͼ1��ʾ��
����0��20Сʱ�ڣ�����ķ�Ӧ����v����v����v���Ӵ�С��˳��Ϊ������
�ڽ�0.4mol�����0.4molˮ��������2L���ݵ��ܱ������У�ij�����·�Ӧ�ﵽƽ�⣬������������ʵ���Ũ��Ϊ0.3mol•L��1����������´˷�Ӧ��ƽ�ⳣ��K=�����������ת����Ϊ������
�������İٷֺ�������ϵ��ѹǿ��P�����¶ȣ�T���Ĺ�ϵ��ͼ2��ʾ��
ƽ��״̬��A�䵽Bʱ����Ӧ��ƽ�ⳣ����K��A������K��B�������������������=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��2010��ŵ������ѧ������ߵ����������ĺտ˷�Ӧ��������Ӧ����ľ��Ӧ�ѳ�Ϊ��ѧ�������츴�ӻ�ѧ���ӵġ����¹��ߡ����ڿ��С�ҽҩ�͵��ӵ������Ѿ��㷺Ӧ�á������������������ľ��Ӧ�ϳɳ�����һ��������������� ��

����������ȷ���� �� ��
A���÷�ӦΪ�ӳɷ�Ӧ����ԭ�������ʴ�100%
B�������������������ڷ�����
C���������������ﱽ���ϵ�һ����ȡ��������5��
D���������������ﲻ��ʹ��ˮ��ɫ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com