

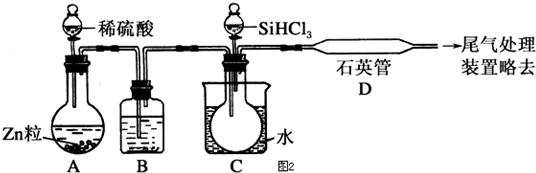
分析 石英砂主要成分为二氧化硅,粗硅提纯是利用碳做还原剂还原二氧化硅为单质硅,二氧化硅和碳在高温下反应生成硅和一氧化碳,反应中二氧化硅为氧化剂,碳为还原剂;
反应①为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,反应②是由粗硅制取三氯甲硅烷,反应的化学方程式是:Si+3HCl$\frac{\underline{\;573K以上\;}}{\;}$SiHCl3+H2,反应③精馏得到SiHCl3,反应④氢气和纯SiHCl3反应生成高纯硅和氯化氢:SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl.
(1)高温下,碳和二氧化硅反应生成硅和一氧化碳;1357K下,SiHCl3和H2反应生成硅和氯化氢;
(2)①浓硫酸具有吸水性,可作干燥剂,防止SiHCl3与H2O强烈反应;升高温度能使SiHCl3气化;
②高温条件下,SiHCl3和H2发生氧化还原反应而得到Si单质;不能用普通玻璃,高温下反应时,普通玻璃会软化;
③SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气,氢气易爆炸;整个制备过程必须严格控制无水无氧;
(3)A.碳化硅(SiC)俗称金刚砂,SiC为原子晶体,硬度很大;B.原子晶体熔点高硬度大;
C.光导纤维的主要成分是二氧化硅;D.普通玻璃是由纯碱、石灰石和石英制成的,无固定熔点;E.硅与盐酸不反应.
解答 解:(1)高温下,碳和二氧化硅反应生成硅和一氧化碳,反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,高温下,SiHCl3和氢气反应生成硅单质,反应方程式为:SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl;
(2)①为防止SiHCl3与H2O强烈反应,需要干燥剂干燥氢气,浓硫酸具有吸水性且不和氢气反应,所以装置B中的试剂是浓硫酸;升高温度能使SiHCl3气化,从而使SiHCl3和氢气在D中反应,
故答案为:浓硫酸;使滴入烧瓶中的SiHCl3气化;
②D中发生反应,SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl,Si为固态,所以看到的现象是有固体物质生成,SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化,
故答案为:有固体物质生成;在此反应温度下,普通玻璃会软化;
③SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:SiHCl3+3H2O═H2SiO3+H2↑+3HCl,氢气遇氧气易爆炸,所以整个制备过程必须严格控制无水无氧,
故答案为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl;高温下,H2与O2混合发生爆炸;无水无氧;
(3)A.SiC为原子晶体,硬度大,碳化硅(SiC)俗称金刚砂,常用作砂轮及高温炉的材料,故A正确;
B.Si3N4为原子晶体,硬度大,熔点高,性质稳定,可用于制作高温陶瓷和轴承,故B正确;
C.光导纤维的主要成分是二氧化硅,是利用光的全反射原理,故C正确;
D.普通玻璃的主要成分为Na2SiO3和CaSiO3,它是以石英砂(SiO2)、石灰石(CaCO3)和纯碱(Na2CO3)为主要原料反应制成的,玻璃属于混合物,没有固定的熔点,故D错误;
E.常温下,Si只能与唯一一种酸HF反应,不与HCl反应,故E错误;
故答案为:ABC.
点评 本题考查较为综合,涉及氯气和二氧化硅的知识,侧重于学生的分析能力和元素化合物知识的综合运用的考查,注意硅及其化合物的性质,题目难度中等.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应①是熵减小的反应,而反应②是熵增大的反应 | |
| B. | 反应②高温时能自发迸行.是由于生成CO2使熵值增大 | |
| C. | 上述事实说明的H2SiO3酸性有时比H2CO3强,有时比H2CO3弱 | |
| D. | H2CO3酸性强于H2SiO3,不能用反应②进行解释 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.
过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol O2和 0.3mol H2O | |
| B. | 0.1mol H2SO4和3.6g H2O | |
| C. | 0.1mol MgSO4•7H2O和0.1mol C12H22O11(蔗糖) | |
| D. | 6.02×1023个CO2与0.1mol KMnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠的电离方程式:NaHCO3═Na++H++CO${\;}_{3}^{2-}$ | |
| B. | 用铜做阳极电解氯化铜溶液的离子方程式:Cu2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑ | |
| C. | 硫化钠水解的离子方程式:S2-+2H2O═H2S+2OH- | |
| D. | 用TiCl4制备TiO2的化学方程式:TiCl4+(x+2)H2O(过量)?TiO2•x H2O↓+4HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如下图所示.正极反应式为PbSO4+2Li++2e-=Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如下图所示.正极反应式为PbSO4+2Li++2e-=Li2SO4+Pb.下列说法不正确的是( )| A. | 放电过程中,Li+向正极移动 | |
| B. | 常温下电解质是不导电的固体,电池不工作 | |
| C. | 每转移0.1 mol 电子,理论上生成20.7 g Pb | |
| D. | 该电池总反应为 PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量卤代烃加入NaOH水溶液共热,冷却,再加入AgNO3溶液检验卤代烃中卤原子的存在 | |
| B. | 用酸性KMnO4溶液直接检验乙醇与浓硫酸反应是否得到乙烯 | |
| C. | 用燃烧的方法鉴别甲烷与苯 | |
| D. | 用新制CaO检验乙醇中是否含有水分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com