
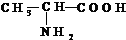 ,请回答下列问题.
,请回答下列问题. .
. 为:CH2=CHCN、CH2=CHCH=CH2、CH2=CHC6H5.
为:CH2=CHCN、CH2=CHCH=CH2、CH2=CHC6H5. 分析 该有机物含有氨基和羧基,其中氨基具有碱性,可与酸反应,羧基为酸性官能团,可与碱反应,该有机物既有酸性,也有碱性,可发生缩聚反应生成高分子化合物,以此解答该题.
解答 解:(1)由有机物结构简式可知有机物中含有3个C、7个H、1个N、2个O,则分子式为C3H7NO2,故答案为:C3H7NO2;
(2)该有机物含有氨基和羧基,故答案为:氨基;羧基;
(3)该有机物含有羧基,可与氢氧化钠发生中和反应,生成-COONa,产物为 ,故答案为:
,故答案为: ;
;
(4)该有机物含有羧基,可与NaHCO3溶液、NaOH等溶液反应,含有氨基,可与酸反应,则该有机物既有酸性,也有碱性,为两性化合物,故答案为:ab.
(5) 为加聚产物,对应的单体有CH2=CHCN、CH2=CHCH=CH2、CH2=CHC6H5,
为加聚产物,对应的单体有CH2=CHCN、CH2=CHCH=CH2、CH2=CHC6H5,
故答案为:CH2=CHCN;CH2=CHCH=CH2; CH2=CHC6H5.
点评 本题考查有机物的结构和性质,题目难度不大,注意把握有机物官能团的性质,为解答该类题目的关键.


科目:高中化学 来源: 题型:解答题
 已知反应:2NO2(g)?N2O4(g),△H<0,为了探究温度对化学平衡的影响,有人做了如图实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500mL 6mol/L的HCl溶液和盛有500mL蒸馏水的烧杯中(两烧杯中溶液的温度相同).
已知反应:2NO2(g)?N2O4(g),△H<0,为了探究温度对化学平衡的影响,有人做了如图实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500mL 6mol/L的HCl溶液和盛有500mL蒸馏水的烧杯中(两烧杯中溶液的温度相同).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:
将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,请推测其具有的化学性质,填写下列空白:
,请推测其具有的化学性质,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗铜作阳极,其电极反应式:Cu2++2e-=Cu | |
| B. | 电解过程中,电解质溶液中c(Cu2+)不变 | |
| C. | 电解后,阴极上还附有极少量的Fe和Ni | |
| D. | 电解后,可用阳极泥来提炼金、银等贵金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 与金属钠作用时,键①断 | |
| B. | 燃烧时,①②③④⑤键均断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在银催化下和氧气反应时,键①和③断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com