

| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.20 | 21.40 |
| 2 | 0.00 | 21.00 |
| 3 | 1.60 | 26.60 |
分析 市售铁屑(含少量锡、氧化铁等杂质),加入稀硫酸可生成Sn2+、Fe2+,经过滤后在滤液中加入稀硫酸酸化调节pH=2,并通入硫化氢气体,除去溶液中的Sn2+,并防止Fe2+被氧化,过滤除去SnS,滤液中主要含有硫酸亚铁,经蒸发浓缩、冷却结晶、过滤洗涤可得到FeSO4•7H2O.
(1)可用KSCN检验铁离子;
(2)根据硫化氢具有还原性的性质以及生成SnS沉淀的性质判断;
(3)由溶液得到晶体,可经蒸发浓缩、冷却结晶、过滤洗涤得到;
(4)为减少实验误差,可重复②③1~2次;洁净的滴定管在滴定前必须进行检漏和润洗;
(5)洁净的滴定管在滴定前必须进行检漏和润洗,可用蒸馏水洗涤2~3次,再用高锰酸钾标准溶液润洗滴定管2~3次;
(6)用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.10mL,则
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.05000mol/L×0.0210L
计算得到;n(Fe2+)=0.00525mol;
则250mL溶液中含Fe2+=0.00525mol×$\frac{250}{25}$=0.0525mol;
利用铁元素守恒关系式计算.
解答 解:市售铁屑(含少量锡、氧化铁等杂质),加入稀硫酸可生成Sn2+、Fe2+,经过滤后在滤液中加入稀硫酸酸化调节pH=2,并通入硫化氢气体,除去溶液中的Sn2+,并防止Fe2+被氧化,过滤除去SnS,滤液中主要含有硫酸亚铁,经蒸发浓缩、冷却结晶、过滤洗涤可得到FeSO4•7H2O.
(1)可用KSCN检验铁离子,方法为取少量绿矾晶体加水溶解,滴加KSCN溶液,看溶液是否呈红色,步骤为:取少量溶于水配成溶液,滴加1~2滴KSCN溶液,振荡,若变为红色溶液则含有Fe3+,否则不含Fe3+,
故答案为:取少量溶于水配成溶液,滴加1~2滴KSCN溶液,振荡,若变为红色溶液则含有Fe3+,否则不含Fe3+;
(2)硫化氢具有还原性,通入硫化氢气体,把Fe3+还原成Fe2+,除去溶液中的Sn2+,并防止Fe2+被氧化,在溶液中用硫酸酸化至pH=2的目的是防止Fe2+生成沉淀,因可FeS可溶于酸,
故答案为:把Fe3+还原成Fe2+,除去溶液中的Sn2+,并防止Fe2+被氧化; 防止Fe2+生成沉淀;
(3)由溶液得到晶体,可经蒸发浓缩、冷却结晶、过滤洗涤得到,
故答案为:蒸发浓缩;过滤洗涤;
(4)为减少实验误差,可重复②③1~2次,或做平行实验1~2次,
故答案为:重复操作②③1~2次或做平行实验1~2次;
(5)①洁净的滴定管在滴定前必须进行检漏和润洗,可用蒸馏水洗涤2~3次,再用高锰酸钾标准溶液润洗滴定管2~3次,
故答案为:用蒸馏水洗涤2~3次,再用高锰酸钾标准溶液润洗滴定管2~3次;
(6)用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.10mL,则
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.05000mol/L×0.0210L
解得n(Fe2+)=0.00525mol,
则250mL溶液中含Fe2+=0.00525mol×$\frac{250}{25}$=0.0525mol,
FeSO4•7H2O物质的量为0.0525mol,质量=0.0525mol×278g/mol=14.595g,
质量分数=$\frac{14.595g}{15.041g}$×100%=97.5%=0.975,
故答案为:0.975.
点评 本题考查物质分离以及含量的测定,为高考常见题型,题目较为综合,侧重于铁盐亚铁盐的性质应用,分离混合物的实验方法设计和分析判断,滴定实验的分析判断,数据计算,误差分析的方法的考查,题目难度中等.


科目:高中化学 来源: 题型:填空题
 ,C原子的结构示意图为
,C原子的结构示意图为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | |
| B. | 钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 氯气和水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 人们研究金星大气成分,发现金星大气中有一种称之为羰基硫(COS)的分子,已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断有关说法正确的是( )
人们研究金星大气成分,发现金星大气中有一种称之为羰基硫(COS)的分子,已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断有关说法正确的是( )| A. | 羰基硫属于非极性分子 | |
| B. | 羰基硫的电子式为 | |
| C. | 羰基硫的沸点比CO2低 | |
| D. | 羰基硫分子中三个原子处于同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
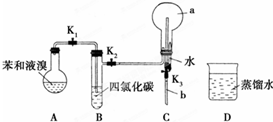
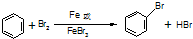 ,烧瓶a中的实验现象是烧杯中的水沿玻璃管上升进入烧瓶,形成喷泉.
,烧瓶a中的实验现象是烧杯中的水沿玻璃管上升进入烧瓶,形成喷泉.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、Cl-、NO3- | B. | Pb2 +、Hg2 +、S2 -、SO42 - | ||
| C. | NH4+、H+、S2O32-、PO43- | D. | ClO-、Al3 +、Br-、CO32 - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Z>W>Y>X | |
| B. | Y的最高价氧化物对应的水化物可与其气态氢化物发生化合反应 | |
| C. | 气态氢化物的稳定性Z>W | |
| D. | X与Y的最高正化合价之和的数值等于10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com