
 ��
�� ��д����һ���εĵ���ʽ
��д����һ���εĵ���ʽ ��
�� ���� ��1�����ý���Ԫ������÷ǽ���Ԫ��֮���γ����Ӽ��������������ӻ����������ԭ��ʧȥ�������ӣ���Nԭ�ӣ�ʹNԭ�������ﵽ�ȶ��ṹ������ʽ��Ҫ��ע���������������
��2����������ˮ��Ӧ����NH3��һ��ǿ����ݷ�Ӧ����ʽ���ص㣬ǿ��ֻ����NaOH��ʵ����Na+���ˮ�������OH-��N3-���ˮ�������H+�������ڸ��ֽⷴӦ��
��3�����������ӵĺ�������Ų���ͬ����������Ų���ͬ�����Ӱ뾶��ԭ���������������С��
��4������þ���ᷴӦ�����Ȼ�þ���Ȼ�泥�MgCl2�������ӻ����þ����������������ͨ�����Ӽ���ϣ��Ȼ��Ϊ���Ӿ��壬�ɰ���������������ͨ�����Ӽ������һ��
��� �⣺��1��NԪ����Na֮���γ����Ӽ��������������ӻ����������ԭ��ʧȥ�������ӣ���Nԭ�ӣ�ʹNԭ�������ﵽ�ȶ��ṹ�������ʽΪ�� ��
��
�ʴ�Ϊ�����ӣ����ӣ� ��
��
��2����������ˮ��Ӧ����NH3��һ��ǿ����ݷ�Ӧ����ʽ���ص㣬ǿ��ֻ����NaOH���䷴Ӧ����ʽ��Na3N+3H2O=NH3��+3NaOH��ʵ����Na+���ˮ�������OH-��N3-���ˮ�������H+�������ڸ��ֽⷴӦ��
�ʴ�Ϊ�����ֽ⣻Na3N+3H2O=NH3��+3NaOH��
��3�����������ӵĺ�������Ų���ͬ����������Ų���ͬ�����Ӱ뾶��ԭ���������������С����r��Na+����r��N3-�����ʴ�Ϊ������
��4������þ���ᷴӦ�����Ȼ�þ���Ȼ�泥�MgCl2�������ӻ����þ����������������ͨ�����Ӽ���ϣ�MgCl2�������ӻ����Mg������������ӱ�����Clԭ�ӵõ����õ���ʽ��ʾ�γɹ���Ϊ ���Ȼ�������ӻ�����ɰ��������������ӹ��ɣ�����ʽΪ��
���Ȼ�������ӻ�����ɰ��������������ӹ��ɣ�����ʽΪ�� ��
��
�ʴ�Ϊ������ ��
�� ��
��
���� ���⿼�����ʽ����ѧ��Ӧ����ʽ����ѧ�������Ӱ뾶�Ĵ�С�Ƚϵ�֪ʶ����Ҫ���������ʵ�����Ӧ�ã����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ������ڿ���ѧ���Ի���֪ʶ��Ӧ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
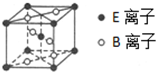 A��B��C��D��EΪ�˵�����������������Ԫ�أ�A�Ļ�̬ԭ������2��δ�ɶԵ��ӣ�B�ǵؿ��к�������Ԫ�أ�C�Ƕ�����������õĽ���Ԫ�أ�D��C���γ�CD�����ӻ����E�Ļ�̬ԭ��3d�������2�����ӣ���ش��������⣺
A��B��C��D��EΪ�˵�����������������Ԫ�أ�A�Ļ�̬ԭ������2��δ�ɶԵ��ӣ�B�ǵؿ��к�������Ԫ�أ�C�Ƕ�����������õĽ���Ԫ�أ�D��C���γ�CD�����ӻ����E�Ļ�̬ԭ��3d�������2�����ӣ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ�� ��� | ʵ��Ŀ�� | �¶�/�� | ���� ����/g | ��Ӧ���ʼŨ�� /10-3mol•L-1 | |
| H2 | I2 | ||||
| �� | Ϊ����ʵ�������� | 457 | 0 | 7 | 9 |
| �� | �� | 420 | �� | 7 | 9 |
| �� | ̽�������Ը÷�Ӧ���ʵ�Ӱ�� | �� | 10 | 7 | 9 |
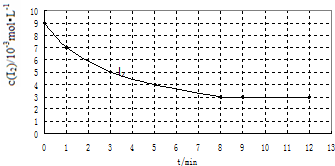
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
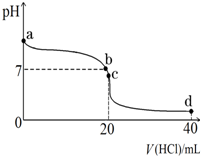 ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ��Ϊ�ⶨ�����Ũ����ʵ�����н�������ʵ�飺�����������գ�
ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ��Ϊ�ⶨ�����Ũ����ʵ�����н�������ʵ�飺�����������գ�| ʵ���� | NaOH��Һ����������mL�� | ����������Һ�������mL�� |
| 1 | 22.62 | 20.00 |
| 2 | 22.72 | 20.00 |
| 3 | 22.80 | 20.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
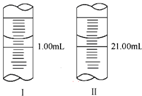 ������ѧ���ò����ƾ��壨Na2C2O4��Һ��ɫ����Ϊ�����ʲⶨ����KMnO4��Һ��Ũ�ȣ�
������ѧ���ò����ƾ��壨Na2C2O4��Һ��ɫ����Ϊ�����ʲⶨ����KMnO4��Һ��Ũ�ȣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
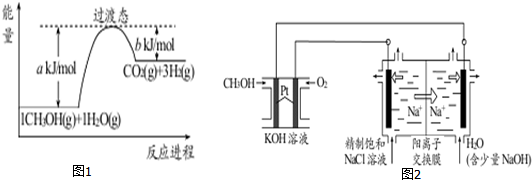
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na��Mg��Al��ԭ��������ǿ | |
| B�� | HCl��PH3��H2S�ȶ������μ��� | |
| C�� | NaOH��KOH��Ca��OH��2��������� | |
| D�� | S2-��Cl-��K+��Ca2+���Ӱ뾶���μ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 L 1 mol•L-1��NaClO ��Һ�к���ClO-����ĿΪNA | |
| B�� | ���³�ѹ�£�4.6gCH3CH2OH�к��� 6NA��C-H�� | |
| C�� | ���³�ѹ�£�14 g ��N2��CO��ɵĻ�����庬�е�ԭ����ĿΪNA | |
| D�� | ��״���£�6.72 L NO2��ˮ��ַ�Ӧת�Ƶĵ�����ĿΪ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��2mol SO3����ͨ��һ���ܱ������У���Ӧ�ﵽƽ�������Q kJ��������÷�Ӧ���Ȼ�ѧ����ʽΪ 2SO3��g��?2SO2��g��+O2��g����H=+Q kJ•mol-1 | |
| B�� | ��0.1mol/L��pH=1��NaHA��Һ�м���NaOH��Һ��H++OH-=H2O | |
| C�� | �Խ�����Ϊ������ⱥ������ͭ��Һ��Cu2++2H2O=2Cu+O2��+4H+ | |
| D�� | NH4Al��SO4��2��Һ�м���Ba��OH��2��ҺʹSO42-��ȫ������Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4��+2H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com