
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
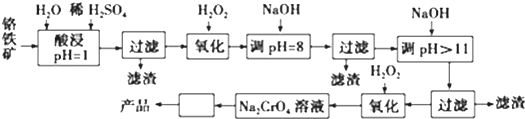
分析 铬铁矿用稀硫酸酸浸,FeO、Cr2O3、MgCO3、Al2O3与硫酸反应加入溶液,而SiO2不反应,过滤除去SiO2.用H2O2将Fe2+氧化为Fe3+,再调节pH=8时,Fe3+、Al3+完全沉淀,过滤得到滤渣为Al(OH)3和Fe(OH)3,再调节pH=11,Mg2+完全沉淀被除去且Cr元素以CrO2-的形式存在,过滤后,向滤液中再加入过氧化氢,将CrO2-氧化为CrO42-,最后采取蒸发浓缩、冷却结晶的方法得到Na2CrO4晶体.
(1)第一次加入H2O2是为了将Fe2+氧化为Fe3+,第二次加入H2O2是为了将CrO2-氧化为CrO42-;
(2)Na2CrO4溶液得到Na2CrO4晶体,可以采取蒸发浓缩、冷却结晶的方法;
(3)当pH=8时Fe3+、Al3+已完全沉淀,pH>11时,Mg2+完全被除去且Cr元素以CrO2-的形式存在;
(4)“调pH=8”时沉淀成分是Al(OH)3和Fe(OH)3,如果不把前者除去,当继续加入NaOH至pH=11时,Al(OH)3会溶解,引入杂质离子AlO2-;
解答 解:(1)第一次加入H2O2是为了将Fe2+氧化为Fe3+,反应离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O;第二次加入H2O2是为了将CrO2-氧化为CrO42-,反应离子方程式为:2CrO2-+3H2O2+2OH-═2CrO42-+4H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;2CrO2-+3H2O2+2OH-═2CrO42-+4H2O;
(2)Na2CrO4溶液得到Na2CrO4晶体,可以采取蒸发浓缩、冷却结晶的方法,
故答案为:蒸发浓缩、冷却结晶;
(3)由阳离子转化为氢氧化物完全沉淀的pH数据,可知当pH=8时Fe3+、Al3+已完全沉淀,pH>11时,Mg2+完全被除去且Cr以CrO2-的形式存在,
故答案为:Fe3+、Al3+;Mg2+;
(4)“调pH=8”时沉淀成分是Al(OH)3和Fe(OH)3,如果不把前者除去,当继续加入NaOH至pH=11时,Al(OH)3会溶解,引入杂质离子AlO2-,
故答案为:不能,当pH=8时Al3+已经完全转化为Al(OH)3,若不经过滤除去,当继续加入NaOH时Al(OH)3会溶解,引入杂质离子AlO2-.
点评 本题属于工艺流程制备题目,考查制备原理、实验方案评价、物质分离提纯、获取信息的能力,是对基础知识的综合考查,难度中等.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:多选题
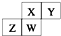 如图为元素周期表截取的短周期的一部分,四种元素均不是稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表截取的短周期的一部分,四种元素均不是稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | z的最高正化合价与最低负化合价的绝对值可能相等 | |
| D. | w的最高价氧化物的水化物可能为弱酸,也有可能为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者都能形成酸雨 | B. | 两者都能与NaOH溶液反应 | ||
| C. | 两者都既有氧化性,又有还原性 | D. | 两者与水反应都生产强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | C-C | C═C | C-H | H-H |
| 键能/(kJ•mol-1) | 348 | 610 | 413 | 436 |
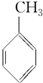 (g)+3H2(g)→
(g)+3H2(g)→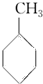 (g)的反应热;
(g)的反应热;| A. | ①②③④ | B. | ③④⑤ | C. | ④⑤ | D. | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com