
【题目】有甲、乙、丙三个体积均为2L的恒容密闭容器,按不同投料比Z[![]() 进行反应: 4HCl(g)+O2(g)
进行反应: 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
容器 | 起始时 | 平衡时HCl转化率 | |||
n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
甲 | 0.8 | a | 96% | 94% | 90% |
乙 | 0.8 | b | 46% | 44% | 40% |
丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是
A.b<4
B.温度升高时,反应速率减慢,所以转化率下降
C.丙容器中,300℃平衡时,c(O2)=0.04molL-1
D.若甲容器温度在300时需要5min达到平衡,则此时间内v(Cl2)=0.036molL-1min-1
科目:高中化学 来源: 题型:
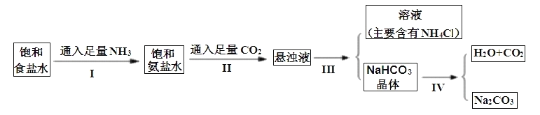
【题目】侯德榜是在中国化学工业史上一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,以下是侯德榜先生制碱工业的简要流程:
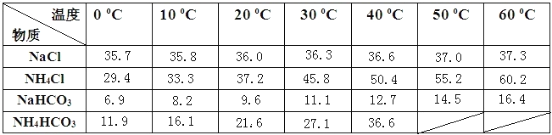
下表是四种物质在100g水中不同温度的溶解度,其中NH4HCO3水溶液呈碱性,性质不稳定,36℃时开始分解为二氧化碳、氨和水,60℃可以分解完。
试回答下列问题:
(1)IV的反应条件是加热,请尝试写出IV的反应方程式:________________________。
(2)Ⅲ的操作名称叫____________。
(3)通过上述溶解度表,如何从含有少量NaCl的NH4Cl溶液中获得NH4Cl晶体:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值。下列说法正确的是( )
A.标准状况下,22.4LCl2中所含的原子数为2NA
B.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数目为0.5NA
C.0.5mol·L-1NaCl溶液中所含的氯离子数目为0.5NA
D.常温下,28g氮气中所含的原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.氯气通入水中,溶液呈酸性:Cl2 + H2O ![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B.向氯化铝溶液中加入过量氨水: Al3+ + 4OH-=AlO2-+ 2H2O
C.碳酸氢铵溶液中加足量的氢氧化钠溶液:NH4+ + OH- = NH3↑ + H2O
D.二氧化硫通入溴水中,溴水褪色:SO2 + Br2 + 2H2O = 4H+ + 2Br- + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和铁都是生活中常用的金属。
(1)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。
①写出该反应的离子方程式__________________;
②用双线桥标出该反应电子转移的方向和数目___________________;
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
③若19.2g铜与足量硝酸完全反应,被还原的硝酸为______mol,氧化剂与还原剂物质的量之比为______。
(2)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①写出该反应的化学方程式___________________。
②检验溶液少量Fe3+存在的方法是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中不正确的是
A.常温常压下,71g Cl2含有的氯原子数为2NA
B.1mol Na2O2与H2O完全反应,转移电子数为NA
C.在标准状况下,1L H2O所含分子数为![]()
D.1L 0.5mol/L AlCl3溶液中,含有的Cl–数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物反应机理,对于控制汽车尾气、保护环境有重要意义。
(1)NO在空气中存在如下反应:2NO(g) + O2(g) ![]() 2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g)
2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g) ![]() N2O2(g)ΔH1<0,② ___________;
N2O2(g)ΔH1<0,② ___________;
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为: 4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。
5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。

①在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内,300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小(催化剂均末失效),写出300℃之后脱氮率减小的原因是_________。
②其他条件相同时,请在图中补充在催化剂B作用下脱氮率随温度变化的曲线________。

(3)工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,现有平均组成为NOx的NO、NO2混合气体,通入足量的NaOH溶液中,充分反应后没有气体剩余,则:
①x的取值范围为_________________。
②反应后溶液中n(NO2-)︰n(NO3-)=____________________。(用含x的代数式表示)
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可利用如下反应将二氧化碳转化为甲烷:CO2(g)+2H2O(g) ![]() CH4(g)+2O2(g) ΔH=+802KJ/mol,下图为在恒温、光照、不同初始浓度和不同催化剂(Ⅰ、Ⅱ)作用下,体积为2L的莫比容器中n(CH4)随光照时间的变化曲线。下列说法正确的是
CH4(g)+2O2(g) ΔH=+802KJ/mol,下图为在恒温、光照、不同初始浓度和不同催化剂(Ⅰ、Ⅱ)作用下,体积为2L的莫比容器中n(CH4)随光照时间的变化曲线。下列说法正确的是
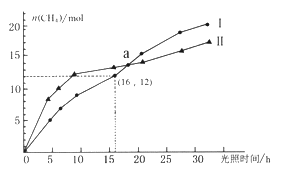
A. 0-15h内,催化剂Ⅱ的催化效果比催化剂Ⅰ效果好
B. 反应开始后的30h内,第Ⅰ种催化剂的作用下,反应吸收的热量多
C. a点时,CO2的转化率相等
D. 0-16h内,v(O2)=1.5mol/(L·h)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温恒容密闭容器中存在反应:X(g)+2Y(g) ![]() Z(g) ΔH=-a kJmol-1(a>0),现向该容器中充入等物质的量的X(g)与Y(g)充分反应。下列说法正确的是
Z(g) ΔH=-a kJmol-1(a>0),现向该容器中充入等物质的量的X(g)与Y(g)充分反应。下列说法正确的是
A.体系中混合气体的平均摩尔质量保持不变时,说明该反应达到化学平衡状态
B.达到平衡时,反应放出的热量一定小于a kJ
C.达到平衡时,X与Y的物质的量之比仍为1∶1
D.达到平衡后,若升高体系温度,则逆反应速率增加、正反应速率减少,平衡逆移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com