
【题目】在恒容密闭容器中,将10mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
A.CO、H2S的转化率之比为1∶1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,平衡不移动
【答案】B
【解析】
A. 利用三段法计算起始时H2S的物质的量,进一步计算转化率;
B. 根据平衡时各物质的物质的量进行计算;
C. 升高温度,COS浓度减小,平衡逆向进行;
D. 根据Qc与K之间的关系进行判断。
A. 设起始时H2S的物质的量为x mol,
CO(g) + H2S(g) ![]() COS(g) + H2(g);
COS(g) + H2(g);
始(mol) 10 x 0 0
转(mol) 2 2 2 2
平(mol) 8 x-2 2 2
平衡常数K= =1,解得x=2.5mol,CO的转化率=
=1,解得x=2.5mol,CO的转化率=![]() ×100%=20%,H2S的转化率=
×100%=20%,H2S的转化率=![]() ×100%=80%,转化率不相等,A项错误;
×100%=80%,转化率不相等,A项错误;
B. 达平衡后H2S的体积分数=![]() ×100%=4%,B项正确;
×100%=4%,B项正确;
C. 升高温度,平衡向吸热的方向移动;升高温度,COS浓度减小,平衡逆向进行,说明正向为放热反应,C项错误;
D. 恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,Qc= =0.67<1说明平衡正向移动,D项错误;
=0.67<1说明平衡正向移动,D项错误;
答案选B。
Q<K | 反应向正反应方向进行,v正>v逆 |
Q=K | 反应处于化学平衡状态,v正=v逆 |
Q>K | 反应向逆反应方向进行,v正<v逆 |


科目:高中化学 来源: 题型:
【题目】ToC时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() X(s) H < 0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是
X(s) H < 0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是
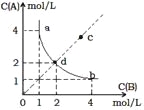
A.ToC时,该反应的平衡常数值为4
B.c点没有达到平衡,此时反应向逆向进行
C.若c点为平衡点,则此时容器内的温度高于ToC
D.ToC时,在d点加入一定量X可达到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,加入1 mol CO和1 mol H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是( )
CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是( )
A. 在该温度下平衡常数K=1
B. 平衡常数与反应温度无关
C. CO的转化率为50%
D. 其他条件不变改变压强平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关电化学示意图如下。回答下列问题:
(1)图中正极的电极反应是______;当Zn片的质量减少0.65g时,外电路中有_____mol电子通过。

(2)预测图中U型管的实验现象是______;结合化学用语解释产生现象的原因____。

(3)用石墨电极电解滴加紫色石蕊溶液的稀Na2SO4溶液,通电后A、B两极均有无色气体生成,装置如图所示:

①NaOH在______极生成(填“A”或“B”)。
②B极发生反应的类型为______反应(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线表示其他条件一定时,2NO(g)+O2(g)![]() 2NO2(g) △H<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
2NO2(g) △H<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
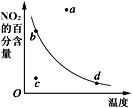
A. a点B. b点C. c点D. d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g) ![]() C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
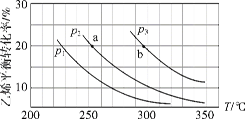
A.乙烯气相直接水合反应的H<0
B.图中压强的大小关系为:p1>p2>p3
C.图中a点对应的平衡常数K =![]()
D.达到平衡状态a、b所需要的时间:a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是![]()
A.硬脂酸与乙醇的酯化反应:![]()
![]()
![]()
B.常温时,![]() 氨水的
氨水的![]() :
:![]()
C.由Na和Cl形成离子键的过程:![]()
![]()
![]()
D.电解精炼铜的阴极反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用铬元素,此工业废水通常采用如下流程处理:

已知:
(1) 铬元素有以下循环过程:

(2) Cu(OH)2能溶于氨水:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答下列问题:
(1)加入试剂甲的目的:__________;
(2)试剂乙的名称:___________,试剂丙的化学式:_________;
(3) 上述操作I、Ⅱ、Ⅲ相同,则进行该实验操作所需要的主要玻璃仪器有________;
(4)滤渣I的主要成分为__________(写化学式)。
(5)在铬元素循环过程的反应①中每反应掉1 mol H2O2同时消耗H+数目为:__________;
(6) 铬元素循环过程的反应⑥的离子方程式______________;废水处理流程中生成滤渣Ⅲ的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜钴矿石主要含有CoOOH、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
I.将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡,过滤,分离除去沉淀a。
II.浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀b[主要成分是Na2Fe6(SO4)4(OH)12]。
III.向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀c。
IV.III中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V.将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生 CoC2O4·2H2O沉淀。分离出沉淀,将其在400℃~600℃ 煅烧,即得到Co2O3。
请回答:
(1)I 中,沉淀a的成分是_____,稀硫酸溶解CoCO3的化学方程式是_____, 加入Na2SO3溶液的主要作用是_________。
(2)根据图1、图2

①矿石粉末浸泡的适宜条件应是:温度_____、pH_____。
②图2中铜、钴浸出率下降的可能原因是_____。
(3)II中,浸出液中的金属离子与NaClO3反应的离子方程式:ClO![]() +_____+_____== Cl- +_____+ _____
+_____+_____== Cl- +_____+ _____
(4)I中,检验铁元素完全除去的试剂是_____,实验现象是_____。
(5)I中,沉淀c的成分是CaF2、_____(填化学式)。
(6)V中,加入Na2CO3的作用是_____。
(7)V中,分离出纯净的CoC2O4·2H2O的操作是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com