
【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | NaOH溶液 | SiO2 | 浓盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③B.②④C.①④D.②③
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】卤素单质在碱性溶液中容易发生歧化反应,歧化的产物依反应温度的不同而不同。
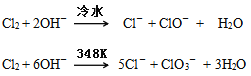
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:

装置中盛装的药品如下:①多用滴管中装有5mL浓盐酸;②微型支管试管中装有1.5gKMnO4;③微型支管试管中装有2~3mL浓硫酸;④U形反应管中装有30%KOH溶液;⑤U形反应管中装有2mol/LNaOH溶液;⑥、⑦双U形反应管中分别装有0.1mol/LKI-淀粉溶液和KBr溶液;⑧尾气出口用浸有0.5mol/LNa2S2O3溶液的棉花轻轻覆盖住

(1)整套装置气密性检查的方法_________________________。
(2)为了使装置④、⑤中的反应顺利完成,应该控制的反应条件分别为________________________________。
(3)装置⑥、⑦中能够观察到的实验现象分别是____________________。
(4)如果把装置⑥、⑦中的试剂互换位置,还能否证明氧化性:Cl2>I2,______(填“能”或“不能”),理由是:______________。
(5)已知氯酸钾和氯化钾的溶解度曲线如下图所示,反应结束后,从装置④中提取氯酸钾晶体的实验操作是_____________。
(6)尾气处理时发生反应的离子方程式为____________________。
(7)选择微型实验装置的优点有___________________(至少写两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧层是地球生命的保护伞,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2![]() 2O3。
2O3。
(1)若上述反应中有30%的氧气转化为臭氧,求所得混合气体的平均摩尔质量______(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,求其中臭氧的体积___________。
(3)加热条件下,O3、O2都能与铜粉反应,实验室中将氧气和臭氧的混合气体0.896 L(标准状况下)通入盛有20.0 g铜粉的反应器中,充分加热后,混合气体被完全吸收,粉末的质量变为21.6 g。求原混合气体中臭氧的体积分数___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,气缸体积一定,内部被活塞隔成ABC三部分,活塞可以自由移动。常温下,A中充入4g氢气, B中充入16g氧气,C中充入4g氦气。
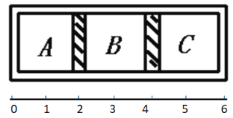
(1)当活塞不移动时,求A、B、C三部分体积比VA:VB:VC。____
(2)拿走A和B之间的活塞,让氢气和氧气充分混合用电火花点燃,恢复到原来的温度,通过计算,判断活塞停止的位置。(用线上数字表示)____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒定温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) ![]() 4C(?)+2D(?),“?”代表状态不确定。5 min后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为15∶14,则下列说法正确的是
4C(?)+2D(?),“?”代表状态不确定。5 min后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为15∶14,则下列说法正确的是
A. 该反应的化学平衡常数表达式是K=[c4(C)·c2(D)]/[c3(A)·c2(B)]
B. 0~5 min内A的反应速率为0.24 mol·L-1·min-1
C. 此时B的平衡转化率是40%
D. 增大该体系的压强,平衡向右移动,化学平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种元素,它们的相关信息如下表:
元素代号 | 相关信息 |
A | 最外层的电子数是次外层电子数的3倍 |
B | 海水中含量第一位的金属元素 |
C | L层得1个电子后成为稳定结构 |
D | 二价阴离子核外有18个电子 |
E | 失去一个电子后就成为一个原子 |
F | 单质为大气中含量最多的气体 |
请填写下列空格:
(1)A原子的电子式:_______________________________。
(2)B离子的结构示意图:__________________________,与B离子质子数与电子数均相同的微粒可能是____________________________________(写出两种,用微粒符合表示)。
(3)C元素的名称:________,C原子中能量最高的电子位于第________层。
(4)D的二价阴离子的电子式:___________________________;D元素的某种同位素原子质量数为34,该原子核内的中子数为______________。
(5)A、E、F三种元素能相互形成多种类别的物质,其中属于共价化合物为________,离子化合物为________(各写出一种物质即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·xH2O)为淡黄色粉末,不溶于水,可作照相显影剂和用于制药工业。某化学兴趣小组对其性质进行如下探究,回答下列问题:
I.定性探究
选用下列试剂设计实验方案,完成下表内容。
试剂:酸性KMnO4溶液、K3[Fe(CN)6]溶液
操作 | 现象 | 结论与解释 |
(1)取少量草酸亚铁晶体于试管中,加入2mL水,振荡后静置 | 有淡黄色沉淀,上层清液无色 | 草酸亚铁不溶于水 |
(2)继续加入2mL稀硫酸,振荡 | ___________ | 草酸亚铁溶于硫酸,硫酸酸性强于草酸 |
(3)向步骤(2)所得溶液中滴加几滴K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | ___________ |
(4)①___________ | ②___________ | H2C2O4或C2O42-具有还原性 |
Ⅱ.定量探究:滴定实验测x的值
(5)滴定前,下列操作的正确顺序是___________(填字母序号)。
a.用0.1000mol/L的酸性KMnO4溶液润洗
b.查漏、清洗
c.排尽滴定管尖嘴的气泡并调整液面
d.盛装0.1000mol/L的酸性KMnO4溶液
e.初始读数、记录为0.50mL
(6)称取ng样品,加入适量稀硫酸溶解,用步骤(5)准备的标准KMnO4溶液直接滴定,如何判断滴定终点?_______________。
(7)终点读数为20.50mL。结合上述实验数据求得x=___________(用含n的代数式表示,FeC2O4的相对分子质量为144)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有相同氧原子数的二氧化硫和三氧化硫,物质的量之比是___,质量之比是___。把4mol/LCuSO4和2mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于混合前溶液的体积之和),求混合溶液中C(CuSO4)=_____mol/L,C(SO42-)=___mol/L。将10毫升2mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为____毫升。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com