

分析 (1)根据分子或离子中中心原子价层电子对数和孤电子对数判断;
(2)氯化铁熔沸点较低,应为分子晶体;同种元素含氧酸,该元素化合价越高,其酸性越强,非羟基氧越多,酸性越强;
(3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2,则Q为Fe、T为Ni;
(4)NaCl属于立方晶体,每个钠离子周围有6个氯离子、每个氯离子周围有6个钠离子;
(5)[Cu(NH3)4]2+中铜离子与氮原子之间形成配位键,氨气分子中N原子与H原子之间形成极性键;
[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,[Cu(NH3)4]2+的空间构型为平面正方形;
(6)根据均摊法计算晶胞中X、Y原子数目,进而计算晶胞的质量,根据m=ρV计算晶胞体积,进而计算晶胞棱长x.Y原子与周围4个X原子形成正四面体结构,令Y与X之间的距离为y,则正四面体中心到底面中心的距离为$\frac{y}{3}$,正四面体的高为$\frac{4}{3}$y,正四面体棱长=$\frac{\sqrt{2}x}{2}$,则正四面体侧面的高为$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$,底面中心到边的距离为$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$×$\frac{1}{3}$,再根据勾股定理进行解答.
解答 解:(1)H3O+中中心原子O的价层电子对数为3+$\frac{1}{2}$(6-1-3×1)=4,孤电子对数为1,所以空间构型是三角锥形;H2O中中心原子O的价层电子对数为2+$\frac{1}{2}$(6-2×1)=4,孤电子对数为2,所以空间构型是V形;NO2+中中心原子N的价层电子对数为2+$\frac{1}{2}$(5-1-2×2)=2,孤电子对数为0,所以空间构型是直线形;NO2-中中心原子N的价层电子对数为2+$\frac{1}{2}$(5+1-2×2)=3,孤电子对数为1,所以空间构型是V形,
故答案为:bd;
(2)FeCl3的沸点:319℃,熔点:306℃,熔沸点较低,应属于分子晶体;
H3PO4、HPO3、H3PO3中P元素化合价依次为+5、+5、+3,H3PO4、HPO3中非羟基氧依次为1、2,元素化合价越高,其酸性越强,非羟基氧越多,酸性越强,故酸性HPO3>H3PO4>H3PO3,
故答案为:分子晶体;HPO3>H3PO4>H3PO3;
(3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2,则Q为Fe、T为Ni;
Ni的基态原子外围电子(价电子)排布式为3d84s2,Fe2+的核外电子排布为1s22s22p63s23p63d6,3d能级有4故未成对电子,
故答案为:3d84s2;4;
(4)由于在NaCl晶体中,每个Na+周围同时吸引着最近的等距离的6个Cl-,每个Cl-周围同时吸引着最近的等距离的6个Na+,图②中符合条件,图③中选取其中一个离子,然后沿X、Y、Z三轴切割得到6个等距离的且最近的带相反电荷的离子,所以其配位数也是6,故符合条件,
故选:②③;
(5)[Cu(NH3)4]2+中铜离子与氮原子之间形成配位键,氨气分子中N原子与H原子之间形成极性键;
[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,[Cu(NH3)4]2+的空间构型为平面正方形,
故答案为:①③;①;
(6)晶胞中X原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、Y原子数目为8,晶胞的质量为$\frac{4a+8b}{{N}_{A}}$g,晶体密度为ρg/cm3,则晶胞体积为为$\frac{4a+8b}{{N}_{A}}$g÷ρg/cm3,故晶胞棱长x=$\root{3}{\frac{4a+8b}{ρ{N}_{A}}}$cm.
Y原子与周围4个X原子形成正四面体结构,令Y与X之间的距离为y,则正四面体中心到底面中心的距离为$\frac{y}{3}$,正四面体的高为$\frac{4}{3}$y,正四面体棱长=$\frac{\sqrt{2}x}{2}$,则正四面体侧面的高为$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$,底面中心到边的距离为$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$×$\frac{1}{3}$,故($\frac{4}{3}$yy)2+($\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$×$\frac{1}{3}$)2=($\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$)2,整理得y=$\frac{\sqrt{3}}{4}$x,故Y与X的距离为$\frac{{\sqrt{3}}}{4}×\root{3}{{\frac{4a+8b}{{ρ•{{N}_A}}}}}$cm;
故答案为:$\frac{{\sqrt{3}}}{4}×\root{3}{{\frac{4a+8b}{{ρ•{{N}_A}}}}}$.
点评 本题考查物质结构与性质,题目涉及微粒构型判断、晶体类型与性质、核外电子排布、化学键、晶胞结构与晶胞计算,(6)中计算为易错点、难点,需要学生具备一定空间想象能力和数学运算能力,难度较大.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:解答题
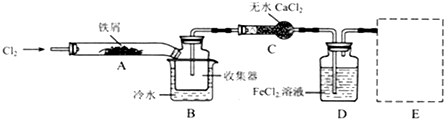
 、Cl2+2OH-=Cl-+ClO-+H2O.
、Cl2+2OH-=Cl-+ClO-+H2O.| 实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液. | 溶液中出现红色. | 说明:假设②不成立,假设①或③成立; 反应的离子方程式是Fe3++3SCN-=Fe(SCN)3. |
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液. | 溶液紫红色退去 | 说明:假设②或③成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可利用过滤的方法分离胶体和溶液 | |
| B. | 胶体中分散质粒子直径大小在1~100nm之间 | |
| C. | 可以利用丁达尔效应区分胶体和溶液 | |
| D. | 胶体在一定条件下能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Mg2+、SO42-、NO3- | B. | NH4+、Ba2+、SO42-、OH- | ||
| C. | K+、Na+、MnO4-、S2- | D. | Na+、Ca2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水是一种弱电解质 | B. | NH4ClO4溶液显酸性 | ||
| C. | NaClO4中含有离子键和共价键 | D. | NH4ClO4只有氧化性,没有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 三乙酸甘油酯是一种优良的溶剂、定香剂和增塑剂.实验室制备三乙酸甘油酯的反应原理、实验装置及相关数据如下:3CH3COOH+
三乙酸甘油酯是一种优良的溶剂、定香剂和增塑剂.实验室制备三乙酸甘油酯的反应原理、实验装置及相关数据如下:3CH3COOH+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +3H2O
+3H2O| 物质 | 相对 分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中 溶解性 |
| 甘油 | 92 | 1.2636 | 290 (分解) | 溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 三乙酸甘油酯 | 218 | 1.1596 | 258 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2在反应中既作氧化剂又作还原剂 | |
| B. | O2是氧化产物 | |
| C. | Na2FeO4既是氧化产物又是还原产物 | |
| D. | 2molFeSO4发生反应时,共有12mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com