
| A. | NH3常用作制冷剂 | |
| B. | 小苏打用制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 二氧化硅常用于制造光导纤维 |
分析 A.氨气易液化;
B.碳酸氢钠不稳定,受热分解生成二氧化碳,碳酸氢钠能和酸反应放出气体还没有腐蚀性,不会对人体造成伤害;
C.生石灰或硅胶不具有还原性;
D.二氧化硅具有光的全反射性.
解答 解:A.氨气易液化,液氨气化时吸收大量的热,可用作制冷剂,故A正确;
B.碳酸氢钠和酸反应能生成二氧化碳,可用来发酵,能够与盐酸反应消耗盐酸,所以也可治疗胃酸过多,故B正确;
C.生石灰或硅胶不具有还原性,不能用于防止食品被氧化而变质,故C错误;
D.二氧化硅具有光的全反射性,可用于制备光导纤维,故D正确.
故选C.
点评 本题综合考查物质的结构和性质,为高频考点和常见题型,侧重于化学与生活、生产的考查,注意相关基础知识的积累,注意把握物质的性质和用途,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都能设计成原电池 | |
| B. | 手机上用的锂离子电池属于一次电池 | |
| C. | 原电池中的阳离子向负极移动 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据
如图为实验室某浓盐酸试剂瓶标签上的有关数据查看答案和解析>>
科目:高中化学 来源: 题型:填空题
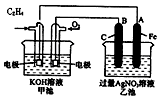 如图是一个化学过程的示意图,请根据该示意图完成下列题目:
如图是一个化学过程的示意图,请根据该示意图完成下列题目:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 纽扣式银锌电池的构造如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )
纽扣式银锌电池的构造如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )| A. | Zn作正极 | B. | 电子经外电路流向Ag2O极 | ||
| C. | OH-向Zn极移动 | D. | 正极反应:Ag2O+H2O+2e-=2Ag+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 金属的硬度都比较大,不能用刀切 | |
| C. | “玉兔”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 煤经过气化和液化等物理变化可转化为清洁燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com