

| A、平衡常数K(300℃)小于K(500℃) | ||
| B、在其他条件下不变时,压缩处于E点的体系体积,甲醇浓度增大 | ||
| C、300℃,当容器内气体密度不变时说明反应已经达到平衡 | ||
D、500℃,从反应开始到平衡,氨气的平均反应速率v(H2)=
|
| c(CH3OH) |
| c(CO)?c3(H2) |
| c(CH3OH) |
| c(CO)?c3(H2) |
| m |
| V |
| nB |
| 3tB |
| 2nB |
| 3tB |


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
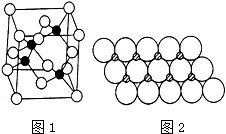 Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题:
Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、分子中所有的原子共面 |
| B、1 mol EGC与4 mol NaOH恰好完全反应 |
| C、遇Fe发生显色反应 |
| D、易发生氧化反应和取代反应,相对较难发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14-a+b |
| B、14+a+b |
| C、14-a-b |
| D、14+a-b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| B、高压比常压有利于合成SO3的反应 |
| C、红棕色的NO2,加压后颜色先变深后变浅 |
| D、黄绿色的氯水光照后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
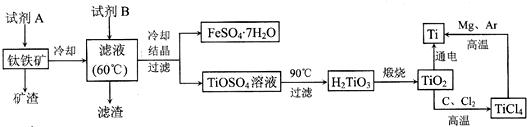
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
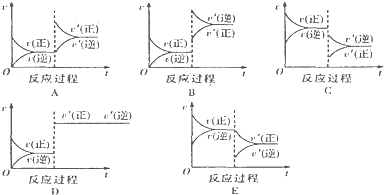
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等温等物质的量浓度溶液中,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大 |
| B、0.2 mol/L NH4Cl溶液和0.1 mol/LNaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| D、同浓度的下列溶液中:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH3?H2O,c(NH4+)由大到小的顺序是①>②>③>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
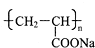 )具有超强吸水性,能吸收空气中的水分,可用于矿山道路运输抑尘等.下列叙述不正确的是( )
)具有超强吸水性,能吸收空气中的水分,可用于矿山道路运输抑尘等.下列叙述不正确的是( )| A、聚丙烯酸钠属于混合物 |
| B、聚丙烯酸钠属于天然有机高分子化合物 |
| C、聚丙烯酸钠可用于生产“尿不湿” |
| D、路面喷洒聚丙烯酸钠溶液能抑制扬尘,一定程度上能预防雾霾和PM2.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com