
分析 (1)FeSO4•x(NH4)2SO4•yH2O的摩尔质量为(152+132x+18y)g/mol,则5.88gFe2(SO4)3•x(NH4)2SO4•yH2O中含有的NH4+的物质的量n(NH4+)=$\frac{5.88}{152+132x+18y}×2x$,加入过量的NaOH溶液并加热,生成的NH3的物质的量,根据氮原子守恒即n(NH3)=n(NH4+)=$\frac{5.88}{152+132x+18y}×2x$,生成的氨气用50mL 1mol•L-1硫酸吸收,再用1mol/L的NaOH溶液中和,生成正盐时消耗NaOH溶液70mL,故NH3消耗的H+的物质的量n=0.05L×1mol/L×2-0.07L×1mol/L=0.03mol,据此列式①;5.88gFeSO4•x(NH4)2SO4•yH2O中含有的SO42-的物质的量n(SO42-)=$\frac{5.88}{152+132x+18y}×(1+x)$,与BaCl2溶液反应生成白色BaSO4沉淀6.99g中所含的SO42-的物质的量相等,据此列式②,两式联立即可解得;
(2)由(1)中硫酸根离子与铵根离子的物质的量之比方可确定x,y.
解答 解:NH4++OH-=NH3+H2O
NH3+ H+=NH4+
OH-+ H+=H2O
Ba2++SO42-=BaSO4
FeSO4•x(NH4)2SO4•yH2O的摩尔质量为(152+132x+18y)g/mol(400+132x+18y)g/mol,则5.88gFe2(SO4)3•x(NH4)2SO4•yH2O中含有的NH4+的物质的量n(NH4+)=$\frac{5.88}{152+132x+18y}×2x$,加入过量的NaOH溶液并加热,生成的NH3的物质的量n(NH3)=n(NH4+)=$\frac{5.88}{152+132x+18y}×2x$,再用1mol/L的NaOH溶液中和,生成正盐时消耗NaOH溶液70mL,故NH3消耗的H+的物质的量n(H+)=0.05L×1mol/L×2-0.07L×1mol/L=0.03mol,而根据反应NH3+H+=NH4+,n(NH3)=n(NH4+)=0.03mol,0.03=$\frac{5.88}{152+132x+18y}×2x$ ①
5.88gFeSO4•x(NH4)2SO4•yH2O中含有的SO42-的物质的量n(SO42-)=$\frac{5.88}{152+132x18y}(1+x)$,与BaCl2溶液反应生成白色BaSO4沉淀6.99g,而6.99gBaSO4沉淀中所含的SO42-的物质的量n(SO42-)=$\frac{6.99g}{233g/mol}$=0.03mol,0.03=$\frac{5.88}{152+132X+18Y}(1+x)$②
将①②联立可解得:x=1,y=6
即该硫酸盐的化学式为FeSO4•(NH4)2SO4•6H2O
答:(1)5.88g摩尔中硫酸根离子与铵根离子的物质的量分别为0.03mol,0.03mol,(2)摩尔盐的化学式为FeSO4•(NH4)2SO4•6H2O.
点评 本题考查了工业尾气的处理的方法和化学方程式的书写以及化学式的求解,综合性较强,难度较大.


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:选择题
| A. | 由 Al、Cu、稀 H2SO4 组成原电池,放电时 SO42-向 Al 电极移动 | |
| B. | 由 Mg、Al、NaOH 溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由 Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出 1 mol Ag时,消耗铜电极32 g | |
| D. | 由 Fe、Cu、FeCl3 溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
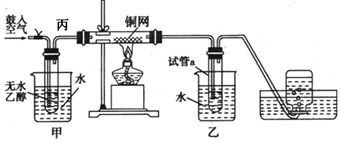
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏法是海水谈化的方法之一 | |
| B. | 海水中的${\;}_{92}^{235}$U元素经浓缩提炼后可作核反应堆燃料 | |
| C. | 海水中的Li元素属于微量元素,提炼后可作Li电池原料 | |
| D. | 0℃以上,温度越高,水的密度越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前3min的平均速率v(Z)=2.0×10-5 mol/(L•min) | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v(正)>v(逆) | |
| C. | 升高温度,该反应的平衡常数将增大 | |
| D. | 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2-叔丁基对苯二酚是一种重要的食品抗氧剂,现以对苯二酚、叔丁醇为原料,一定条件下经Freidel-Crafts 烷基化反应合成.原理如下:
2-叔丁基对苯二酚是一种重要的食品抗氧剂,现以对苯二酚、叔丁醇为原料,一定条件下经Freidel-Crafts 烷基化反应合成.原理如下: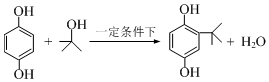
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol甲烷含有的电子数为NA | |
| B. | 1L0.1mol/LNa2CO3溶液中含有的CO32-数目为0.1NA | |
| C. | 1mol-OH (羟基)与l molOH-均含有10个NAe- | |
| D. | 标准状况下,2.24LCO和CO2混合气体中含有的氧原子数为0.15NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com