
| 离子 | H+ | Cl- | Fe2+ | Fe3+ |
| 浓度(mol•L)-1 | 0.16 | 0.94 | 0.18 |
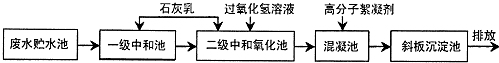
分析 (1)根据废水中含有H+、Cl-、Fe2+、Fe3+等,其中氢离子成酸性会腐蚀水利设施,Fe3+具有强氧化性会影响水生生物的自然生长;
(2)石灰乳与盐酸反应生成氯化钙和水;
(3)过氧化氢的主要作用氧化剂;
(4)氯气与水反应生成具有强氧化性的HClO;
(5)水处理中的主要化学方法有中和法、混凝法、沉淀法、氧化还原法等;
(6)根据电荷守恒计算.
解答 解:(1)因为废水中含有H+、Cl-、Fe2+、Fe3+等,其中氢离子成酸性会腐蚀水利设施,Fe3+具有强氧化性会影响水生生物的自然生长,故选:ab;
(2)石灰乳与盐酸反应生成氯化钙、水和二氧化碳,方程式为:Ca(OH)2+2HCl═CaCl2+2H2O,故答案为:Ca(OH)2+2HCl═CaCl2+2H2O;
(3)过氧化氢具有强氧化性,主要作用氧化剂,故选:b;
(4)氯气与水反应生成具有强氧化性的HClO,可用于杀菌消毒,能杀死水中细菌,故答案为:HClO;
(5)水处理中的主要化学方法有中和法、混凝法、沉淀法、氧化还原法等,故答案为:混凝法;沉淀法;氧化还原法;
(6)根据溶液中电荷守恒得,c(Fe2+)=$\frac{0.94×1-0.16×1-0.18×3}{2}$=0.12mol/L,故答案为:0.12.
点评 本题考查物质的量分离、提纯,侧重考查工业上处理高浓度酸性含铁废水的工艺流程,涉及化学与生活、生产的考查,题目难度中等,本题注意把握题给信息,结合物质基本性质解答.


科目:高中化学 来源: 题型:选择题
| A. | HA为强酸 | B. | 该混合液pH=7 | ||
| C. | 该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) | D. | 该混合溶液中:c(A-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验方案 | 所选玻璃仪器 | |
| A | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 | 酒精灯、烧杯、玻璃棒 |
| B | 证明HClO和CH3COOH的酸性强弱 | 同温下用pH试纸测定浓度为0.1mol•L-1NaClO溶液和0.1mol•L-1CH3COONa溶液的pH | 玻璃棒、玻璃片 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 | 试管、烧杯、酒精灯、滴管 |
| D | 配制1L 1.6%的CuSO4溶液(溶液密度近似为1g/mL) | 将25g CuSO4•5H2O溶解在975水中 | 烧杯、量筒、玻璃棒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3-戊醇发生消去反应时可得2种不同的烯烃 | |
| B. | 聚合物 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 | |
| C. | 醇在Cu/△条件下都能氧化成醛 | |
| D. | 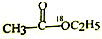 在酸性条件下水解产物是 在酸性条件下水解产物是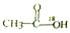 和C2H5OH 和C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不锈钢属于一种铁合金 | |
| B. | 纤维素是蚕丝的主要成分 | |
| C. | 水泥是生活中常见的硅酸盐材料 | |
| D. | 二氧化硅是制造光导纤维的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 3,4-二甲基-4乙基-庚烷
3,4-二甲基-4乙基-庚烷 3-甲基-丁炔
3-甲基-丁炔 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56.8% | B. | 36.4% | C. | 11.2% | D. | 45.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO、Al2O3熔点高,都可用于制作耐火材料 | |
| B. | 氨气显碱性,可用碱石灰或无水CaCl2干燥 | |
| C. | 氢氟酸具有强酸性,可用于雕刻玻璃 | |
| D. | 铜的活动性比铁弱,可在海轮外壳上装铜块以减缓海轮腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com