
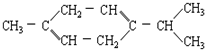
 还可以简写为
还可以简写为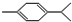 ,下列有机物中,与上述有机物互为同分异构体的是( )
,下列有机物中,与上述有机物互为同分异构体的是( )| A. |  | B. |  | C. | 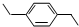 | D. |  |
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH将增大 | B. | 钠离子数和碳酸根离子数的比变小 | ||
| C. | 溶液浓度增大并有晶体析出 | D. | 溶液浓度不变,有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | (1)有机物A的相对分子质量为:90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使 其产物依次通过足量无水硫酸铜粉末、足量石灰水,发现硫酸铜粉末增重5.4g,石灰水中有30.0g白色沉淀生成. | (2)9.0g有机物A完全燃烧时,经计算: 生成CO2共为0.3mol, 生成的H2O0.3mol. 有机物A的分子式C3H6O3. |
| (3)经红外光谱测定,证实其中含有O-H键,-COOH基团,C-H键;经核磁共振氢谱的测定,其核磁共振氢谱图 如:  | (3)A的结构简式 . . |
| (4)如果经红外光谱测定,A的一种同分异构体中,存在O-H键, 还含有醛基,C-O键,  核磁共振氢谱的测定, 其核磁共振氢谱图如右: | (4)A的这种同分异构体的结构简式为: CH2(OH)CH(OH)CHO. |
| (5)如果经红外光谱测定,A的一种同分异构体中,存在O-H键,还含有C=O,C-O键, 核磁共振氢谱的测定, 其核磁共振氢谱图如:  | (5)A的这种同分异构体的结构简式为: . . |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
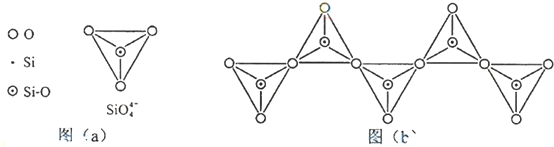
 ;
;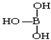 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:H3BO3+H2O?H4BO4-+H+.
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:H3BO3+H2O?H4BO4-+H+.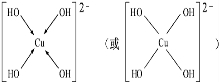 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是直链烃,但分子中碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比其同分异构体丁烷易汽化,耗氧量少 | |
| D. | 燃烧时主要是将化学能转变为热能和光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组用甲、乙两套装置(如图所示)进行甲酸(HCOOH)与甲醇(CH3OH)酯化反应的实验,回答以下问题:
某化学兴趣小组用甲、乙两套装置(如图所示)进行甲酸(HCOOH)与甲醇(CH3OH)酯化反应的实验,回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以采用多次盐析和溶解的方法分离提纯蛋白质 | |
| B. | HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性 | |
| C. | 肽键是蛋白质二级结构中的主键 | |
| D. | 用甘氨酸和丙氨酸缩合最多可以形成3种二肽 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com