
| A | B | C | D |
 |  |  |  |
| SiO2---光导纤维 | 聚氯乙烯---输液管 | 酚醛树脂---飞船仓外层 | 锰钢---钢轨 |
| A. | A | B. | B | C. | C | D. | D |
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:选择题
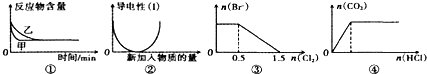
| A. | 图①标上压强可对逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,乙的压强大 | |
| B. | 图②表示向乙酸溶液中通入氨气至过量的过程,溶液导电性变化 | |
| C. | 图③表示在1L1mol/LFeBr2溶液中通入Cl2时Br-的量的变化 | |
| D. | 图④表示一定浓度Na2CO3溶液中逐滴滴加盐酸与生成CO2的物质的量的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,有机物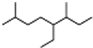 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 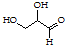 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原反应 | |
| C. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次增加 | |
| D. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子的单体是1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
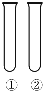 下列①②对应的试剂(或条件)不能完成实验目的是( )
下列①②对应的试剂(或条件)不能完成实验目的是( )| 实验目的 | 试剂(或条件) | |
| A | 温度对Na2S2O3与H2SO4反应速率的影响 | ①热水浴②冷水浴 |
| B | 用Na块检验乙醇分子存在不同与烃分子里的氢原子 | ①乙醇②煤油 |
| C | 用酸化的AgNO3溶液检验来自水中Cl-能否蒸馏除去 | ①自来水②蒸馏水 |
| D | 用溴水检验苯的同系物种取代基对苯活性有影响 | ①苯②甲苯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=l的溶液中:Ca2+、Fe2+、NO3- | |
| B. | $\frac{Kw}{c(O{H}^{-})}$=10-2的溶液中:Na+、NH4+、Cl- | |
| C. | c(Fe3+)=0.1 mol.L-1的溶液中:K+、SCN-、SO42- | |
| D. | 由水电离的c(H+)=1×10-14 mol.L-1的溶液中:Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
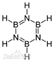 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液:NH4+、Ca2+、NO3-、SO42- | |
| B. | c(OH-)=1×10-13 mol•L-1的溶液:Na+、K+、ClO-、SO42- | |
| C. | 0.1 mol•L-1 FeCl2溶液:K+、Na+、SO42-、NO3- | |
| D. | 0.1 mol•L-1 KMnO4溶液:Na+、Mg2+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com