
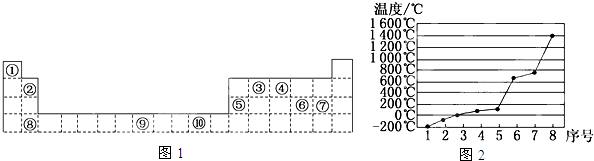
 ;
;分析 由元素在周期表中位置,可知①为H、②为Be、③为C、④为N、⑤为Al、⑥为S、⑦为Cl、⑧为Ca、⑨为Fe、⑩为Cu.
(1)d区元素包括ⅢB-ⅦB元素,Ⅷ族元素,为第3列到10列元素(镧系元素、锕系元素除外);
(2)⑨为Fe元素,属于26号元素,根据核外电子排布规律书写基态原子的电子排布式;
(3)s能级最多容纳2个电子,同一能层中s能级填满后再填充p能级,故n=2,该元素的特征电子排布式为2s2np3,为N元素;
(4)元素④的氢化物为NH3,分子中N一直在形成3个N-H键,还含有1对孤对电子;
(5)第3周期8种元素中Si是原子晶体,单质的熔点最高;第三周期中氯元素电负性最大,常温下氯气、氩气为气体,氯气比氩气的相对分子质量大,熔点仅高于氩气.
解答 解:由元素在周期表中位置,可知①为H、②为Be、③为C、④为N、⑤为Al、⑥为S、⑦为Cl、⑧为Ca、⑨为Fe、⑩为Cu.
(1)d区元素包括ⅢB-ⅦB元素,Ⅷ族元素,为第3列到10列元素(镧系元素、锕系元素除外),由元素在周期表中位置可知,⑨处于第8列,为第Ⅷ族元素,属于d区的元素,
故答案为:⑨;
(2)由元素在周期表中的位置可知,⑨为Fe元素,属于26号元素,基态原子的电子排布式为1S22S22P63S23P63d64S2,
故答案为:1S22S22P63S23P63d64S2;
(3)s能级最多容纳2个电子,同一能层中s能级填满后再填充p能级,故n=2,该元素的特征电子排布式为2s2np3,s能级为成对电子,p能级3个电子个占据1个轨道,故该元素原子的核外最外层电子的成对电子为1对,为N元素,单质电子式为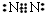 ,
,
故答案为:1;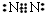 ;
;
(4)元素④的氢化物为NH3,分子中N一直在形成3个N-H键,还含有1对孤对电子,空间构型为三角锥形,N原子采取,sp3杂化,
故答案为:三角锥形;sp3;
(5)第3周期8种元素中Si是原子晶体,单质的熔点最高;同周期自左而右电负性增强,第三周期中Cl元素的电负性最大,氯气常温下为气体,比氩气的相对分子质量大,熔点仅高于氩气,故2代表氯元素,
故答案为:Si;2.
点评 本题考查元素周期表的结构、核外电子排布规律、晶体结构与性质、电负性等,难度不大,整体把握元素周期表的结构,注意晶体类型与物质熔沸点高低比较.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
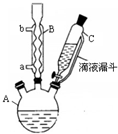 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和浓药的合成,实验室中制备对氯苯甲酸的反应、装置图如图:
对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和浓药的合成,实验室中制备对氯苯甲酸的反应、装置图如图: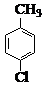 $→_{催化剂}^{KMnO_{4}}$
$→_{催化剂}^{KMnO_{4}}$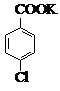 +MnO2
+MnO2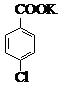
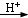
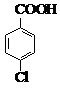
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
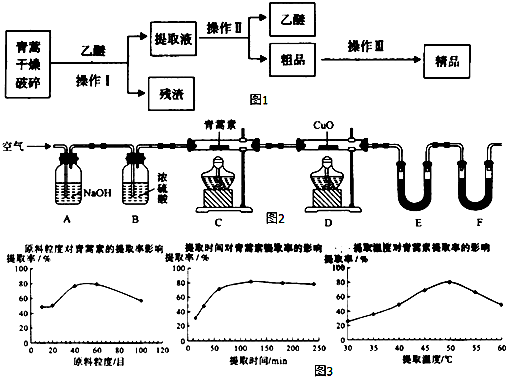
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
| ③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
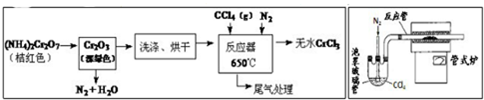
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全球气候变暖可能是由于二氧化碳含量的急剧增加 | |
| B. | 酸雨可以分为硫酸型酸雨和硝酸型酸雨 | |
| C. | 居室中的装潢材料缓慢释放出来的污染物中最常见的是甲醛、苯等有机物蒸气 | |
| D. | 检验居室中甲醛气体是否存在,可以抽取并通过品红溶液来检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

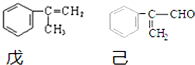
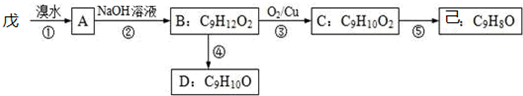
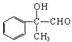
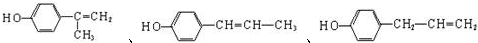 .
.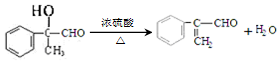 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com