
分析 碳酸氢根离子水解程度大于电离程度,所以碳酸氢钠溶液呈碱性;二氧化硅和能和强碱性溶液反应生成粘性物质硅酸钠;Al2(SO4)3是强酸弱碱盐,但水解出的硫酸不挥发,据此分析.
解答 解:碳酸氢钠由于水解程度大于电离程度,所以溶液呈碱性,由于碱能和玻璃中的二氧化硅反应生成粘性物质硅酸钠,而使瓶塞和瓶口打不开,所以应该用橡皮塞,方程式为HCO3-+H2O?H2CO3+OH-、2OH-+SiO2?SiO32-+H2O;Al2(SO4)3水解生成的硫酸难挥发,最终仍得到Al2(SO4)3,
故答案为:碱;橡胶;HCO3-+H2O?H2CO3+OH-、2OH-+SiO2?SiO32-+H2O;Al2(SO4)3.
点评 本题考查了盐类水解,明确盐类水解原理是解本题关键,根据盐特点确定盐溶液酸碱性.


科目:高中化学 来源: 题型:解答题
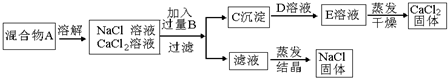
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 开始沉淀的pH值 | 完全沉淀的pH值 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.4 | 4.4 |
| Cr (OH)3 | 4.6 | 5.9 |
| Fe(OH)2 | 7.5 | 9.7 |
| Bi(OH)3 | 0.7 | 4.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
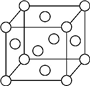 A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:
A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ |
| 溶液 | 0.01mol/L KHC2O4 | 0.01mol/L K2C2O4 | 溶液①与溶液②等体积混合 |
| pH | 3.1 | 8.1 | 未测定 |
| A. | ①中:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| B. | ②中:c(K+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) | |
| C. | ③中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) | |
| D. | ③中:2c(OH-)+c(C2O42-)=3c(H2C2O4)+c(HC2O4-)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
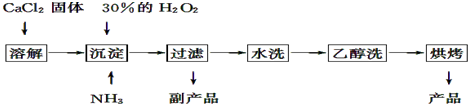
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com