
【题目】某化学反应2A(g)B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 | 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为mol/(Lmin).
(2)在实验2,A的初始浓度c2=mol/L,推测实验2中还隐含的条件是 .
(3)设实验3的反应速率为v3 , 实验1的反应速率为v1 , 则v3v1(填>、<、=),且c31.0mol/L(填>、<、=)
(4)比较实验4和实验1,可推测该反应是反应(选填“吸热”、“放热”).理由是 .
【答案】
(1)0.013
(2)1.0;使用催化剂
(3)>;>
(4)吸热;温度升高,A的平衡浓度减小,说明平衡正向移动,则正向为吸热反应
【解析】解:(1)在实验1,反应在10至20min内,A的浓度的变化量为0.8﹣0.67=0.13(mol/L), 则υ(A)= ![]() =0.013mol/(Lmin),
=0.013mol/(Lmin),
所以答案是:0.013;(2)由表格中的数据可知,实验2和实验1平衡时A的浓度相同,则A的起始浓度相同,即c2=1.0mol/L,
实验2的反应速率快,可能的因素是使用了催化剂,
所以答案是:1.0;使用催化剂;(3)由表格中数据可知,平衡时A的浓度实验3的大,实验1和3的温度相同,则实验3的起始浓度大于1.0mol/L,即c3>1.0mol/L,由于浓度大,其反应速率快,则υ3>υ1 ,
所以答案是:>;>;(4)实验4的温度高,且起始的A的浓度相同,但平衡时A的浓度小,则说明升高温度反应 2AB+D 向正反应方向进行,即正反应为吸热反应,
所以答案是:吸热;温度升高,A的平衡浓度减小,说明平衡正向移动,则正向为吸热反应.
【考点精析】利用化学平衡的计算对题目进行判断即可得到答案,需要熟知反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】铝热反应原理可以应用在生产上,例如焊接钢轨、冶炼难熔金属、制作传统的烟火剂等。某小组同学在研究铝热反应时,进行如下讨论和实验。
(1)关于铝热反应有以下两种认识,其中正确的是___________(填字母号)。
a .该反应需在高温下发生,所以该反应吸热
b.因为铝的还原性较强,所以铝能将相对不活泼的金属从其化合物中置换出来
(2)铝和氧化铁反应的化学方程式是______________________________________。
(3)铝和氧化铁反应所得固体成分的初步确定。
实验序号 | 操作及现象 |
i | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
ii | 向i所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液,产生无色气体(经检验为O2),溶液变为深红色 |
①由上述实验可知:溶液中Fe元素的存在形式有______________________。
②i中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,可选用的试剂是_________________________________。
③ii中生成O2的化学方程式是______________________________。进一步的实验表明,上述固体样品中Fe元素的存在形式有Fe、Fe2O3、Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喷泉是一种常见的现象,其产生原因是存在压强差。下面是某同学设计的四个不同的喷泉装置,则以下说法不正确的是
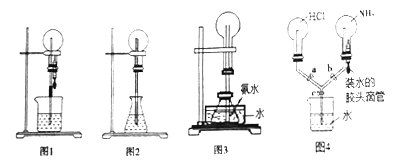
A. 若向图1烧瓶中充满HI(与HCl水溶性相似)气体,烧杯中加入AgNO3溶液,则可以产生黄色喷泉
B. 若向图2锥形瓶中加水,烧瓶中充满SO2,引发喷泉的操作是捂热上方的圆底烧瓶
C. 若向图3装置的水槽中加入冰块或慢慢滴入浓硫酸都可以形成喷泉
D. 图4所示的装置,若要在该装置中产生双喷现象,其操作方法可以是关闭活塞c,打开活塞a、b,再挤压胶头滴管,当产生大量的白烟,再打开活塞c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在密闭容器中发生如下反应:2M(g)+N(g)2E(g)若开始时只充入2molE(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为( )
A.20%
B.40%
C.60%
D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空:
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 .
A.C(s)+H2O(g)=CO(g)十H2(g)△H>O
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<O
C.2H2(g)+O2(g)=2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为: .
(3)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与右图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
①若X和Y均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为 . 通过一段时间后,向所得溶液中加入0.2molCu0粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 .
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为 .
(4)0.2mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出433kJ热量,其燃烧热的热化学方程式为 . 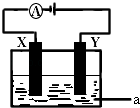
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,选用了下图所示实验装置.
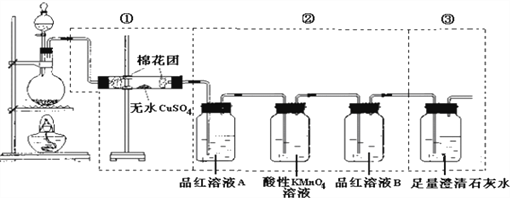
(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式 ___________________________.
(2)①中无水硫酸铜的作用是__________________________.
(3)②中酸性KMnO4溶液的作用是______________________________.
(4)②中两次用到品红溶液,它们的作用分别是A______________,B________________________.
(5)①装置和②装置不能互换的原因_______________________________
(6)证明产物中有CO2的离子反应方程式_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质①乙烷 ②乙炔 ③甲苯 ④苯 ⑤聚乙烯 ⑥对苯二酚 ⑦溴乙烷 ⑧葡萄糖,其中既能与溴水反应又能与酸性高锰酸钾溶液反应的是( )
A.②③④⑤⑧
B.②③④⑥⑦⑧
C.②⑥⑧
D.②⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分物质与条件已略去).已知A是由两种元素组成的黑色粉末,B由两种元素组成、其摩尔质量为65gmol﹣1 , C是空气中含量最多的单质,D是白色粉末且焰色反应呈黄色,E是一种紫红色金属,F是一种无色气体单质,H是一种红棕色气体,I是最常见的液体,K是一种强碱. 
(1)F的化学式为 .
(2)K的电子式为 .
(3)写出反应①的化学方程式:
(4)写出反应②的离子方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com