
| 72 |
| 14 |
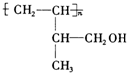 .
. .
.


科目:高中化学 来源: 题型:
| 实验编号 | HCl物质的量浓度(mol?L-1) | AOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.1 | c | pH=7 |
| 丙 | 0.1 | 0.1 | pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
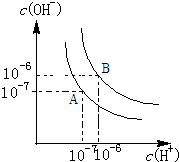 水的电离平衡如图所示.
水的电离平衡如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
| D、c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
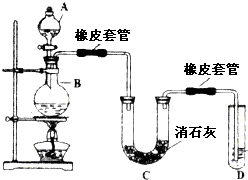 瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(该反应是放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(该反应是放热反应),据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L氯气与足量的NaOH溶液反应,转移的电子数目为2NA |
| B、1L 0.5mol/L FeCl3溶液中Fe3+数目为0.5NA |
| C、常温常压下,8.8g丙烷中所含电子数为5.2NA |
| D、78g过氧化钠中所含阴离子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com