
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
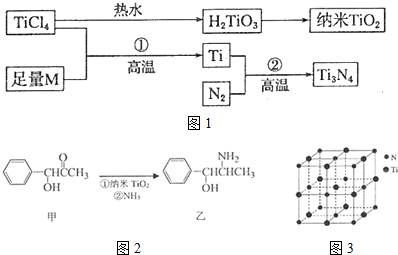
分析 (1)Ti原子核外电子数为22,根据能量最低原理书写;
(2)M是短周期金属元素,M的第三电离能剧增,处于ⅡA族,能与TiCl4反应置换出Ti,则M为Mg,Mg晶体属于六方最密堆积,配位数为12;
(3)采取sp2杂化的碳原子价层电子对数是3,采取sp3杂化的原子价层电子对数是4,乙中采取sp3杂化的原子有C、N、O,同一周期元素中,元素的电负性随着原子序数的增大;
(4)根据均摊法计算晶胞中Ti、N原子数目,进而计算晶胞质量,根据ρ=$\frac{m}{V}$计算晶胞密度;
以晶胞顶点N原子研究,与之距离相等且最近的N原子处于面心位置;
(5)由表中数据可知,离子半径越小晶格能越大,离子带电荷越大,晶格能越大,晶格能大,对应的离子晶体的熔点就越高.
解答 解:(1)Ti为22号元素,原子核外电子排布为1s22s22p63s23p63d24s2,外围电子排布式为3d24s2,
故答案为:3d24s2;
(2)M是短周期金属元素,M的第三电离能剧增,处于ⅡA族,能与TiCl4反应置换出Ti,则M为Mg.Mg晶体属于六方最密堆积,配位数为12,
故答案为:Mg;12;
(3)化合物甲的分子中采取sp2杂化的碳原子为苯环上的六个、羰基中的一个,共7个;
采取sp3杂化的原子价层电子对数是4,乙中采取sp3杂化的原子有C、N、O,同一周期元素中,元素电负性随着原子序数依次增加电负性逐渐增大,所以它们的电负性关系为:O>N>C,
故答案为:7; O>N>C;
(4)根据均摊法,可知该晶胞中N原子个数为:6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,该晶胞中Ti原子个数为:1+12×$\frac{1}{4}$=4,则晶胞的质量m=4×$\frac{62}{{N}_{A}}$g,而晶胞的体积V=(2a×10-10)3cm3,所以晶体的密度ρ=4×$\frac{62}{{N}_{A}}$g÷(2a×10-10)3cm3=$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$g•cm-3;
以晶胞顶点N原子研究,与之距离相等且最近的N原子处于面心位置,每个顶点为8个晶胞共用.每个面为2个晶胞共用,故与之距离相等且最近的N原子为$\frac{3×8}{2}$=12,
故答案为:$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$;12;
(5)离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,则有TiN>CaO,由表中数据可知CaO>KCl,则TiN>CaO>KCl,
故答案为:TiN>CaO>KCl;离子所带的电荷数越高,晶格能越大,熔点越高.
点评 本题考查物质结构和性质,题目难度中等,涉及等晶胞结构与计算、核外电子排布、杂化方式、电负性、晶体熔沸点比较等,注意理解电离能与最外层电子数关系,是对学生综合能力的考查,需要学生具备扎实的基础,试题培养了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②④ | C. | ①③⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原性二糖 | |
| B. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略体积的变化)测得混合溶液的pH=5,则混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| C. | 纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体 | |
| D. | 已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol•L-1的AgNO3溶液和1×10-4 mol•L-1 K2CrO4溶液混合后会有Ag2CrO4沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和N2 | B. | O3和NO2- | C. | N2H4和C2H4 | D. | CO2和N2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
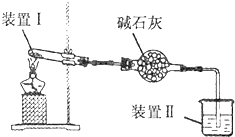 按如图所示装置进行实验,装置中现象II不正确的是( )
按如图所示装置进行实验,装置中现象II不正确的是( )| 选项 | 装置I中试剂 | 装置Ⅱ中试剂 | 装置Ⅱ中现象 |
| A | 浸透了石蜡油的石棉和碎瓷片 | 酸性高锰酸钾溶液 | 紫色溶液褪色 |
| B | 铁粉和用水浸泡的棉团 | 肥皂水 | 肥皂水冒泡 |
| C | 碳酸氢钠 | 澄清石灰水 | 有沉淀生成 |
| D | 硫酸铵 | 酚酞溶液 | 溶液变红 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
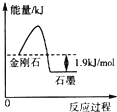 根据表中的信息判断下列说法错误的是( )
根据表中的信息判断下列说法错误的是( )| 物质 | 外观 | 燃烧热/(kJ•mol-1) |
| 金刚石 | 无色、透明固体 | 395.4 |
| 石墨 | 灰黑,不透明固体 | 393.5 |
| A. | 由表中信息可得如图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1 | |
| C. | 由表中信息可知相同条件下金刚石的熔点低于石墨的熔点 | |
| D. | 石墨燃烧热的热化学方程式为C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H=-393.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
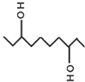
| A. | 该有机物的分子式为C10H20O2 | |
| B. | 该有机物与乙二醇、甘油互为同系物 | |
| C. | 1mol该有机物一定条件下与Na完全反应最多可生成22.4L氢气 | |
| D. | 该有机物一定条件下,可以发生取代、氧化、酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
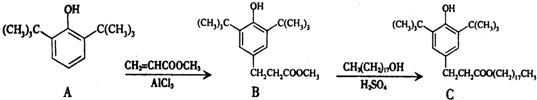
| A. | 物质A是苯甲醇的同系物 | |
| B. | 物质B能发生取代、加聚等反应 | |
| C. | 可用氯化铁溶液鉴别物质C中是否含有CH3(CH2)17OH杂质 | |
| D. | 1 mol物质C与足量NaOH溶液反应,最多可消耗2 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
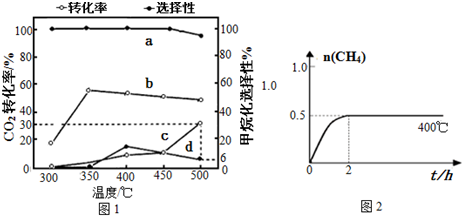
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com