
分析 无色溶液可知一定不含Fe2+、MnO4-,
步骤一:取适量待测液,加入NaOH溶液并加热,得到溶液A,并产生刺激性气味的气体,则一定含NH4+;
步骤二:向溶液A加入足量稀盐酸和BaCl2溶液,得到溶液B、白色沉淀和有刺激性气味的气体,则气体为二氧化硫,一定含SO32-,有白色沉淀白色沉淀为硫酸钡,可知一定含SO42-;
步骤三:往B溶液中通入适量Cl2,得到黄褐色溶液C,C中含碘单质,则原溶液一定含I-,以此来解答.
解答 解:(1)A.由上述分析可知,一定存在SO42-、I-、NH4+、SO32-,故A正确;
B.一定不存在Fe2+、MnO4-,故B错误;
C.可能存在CO32-、Cl-、Na+、K+,故C正确;
D.Cl-的检验用AgNO3溶液和HNO3,故D错误;
故答案为:AC;
(2)氯气具有强的氧化性,能够氧化碘离子,生成单质碘,反应的离子方程式为Cl2+2I-=I2+2Cl-,所以最后溶液颜呈黄褐色;
故答案为:Cl2+2I-=I2+2Cl-;
(3)步骤一加强氧化钠目的是检验NH4+,而Ba(OH)2中也有氢氧根离子同样能检验NH4+,并且提供了氯化钡中钡离子,故答案为:Ba(OH)2;
(4)对于溶液中还可能存在的阳离子,确认其存在的实验方法是,观察焰色反应如果呈现黄色,含有Na+,透过蓝色钴玻璃观察焰色反应如果呈现紫色,含有K+,
故答案为:观察焰色反应如果呈现黄色,含有Na+,透过蓝色钴玻璃观察焰色反应如果呈现紫色,含有K+.
点评 本题考查无机物的推断,为高频考点,把握离子的性质、发生的反应为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量低于生成物的总能量时,发生放热反应 | |
| B. | HCl和NaOH反应的中和热△H=-57.3KJ/mol,则H2SO4和Ba(OH)2的反应热△H=2×(-57.3)KJ/mol | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
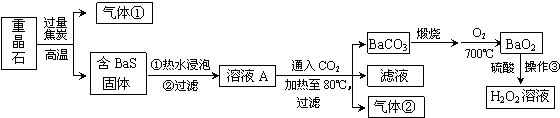
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
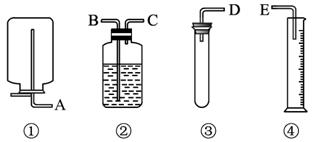 现有药品和如图装置:质量为wg的锌片、稀H2SO4、无水硫酸铜和蒸馏水,
现有药品和如图装置:质量为wg的锌片、稀H2SO4、无水硫酸铜和蒸馏水,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃600℃1000℃2000℃ |
| 主要成分 | Fe2O3 Fe3O4 FeO Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、OH-、CO32- | |
| B. | 在含等物质的量的FeBr2、FeI2溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 在含等物质的量的KOH、Ba(OH)2溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 | |
| D. | 在含等物质的量的Fe3+、Cu2+、H+溶液中加入锌粉:Fe3+、Cu2+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑦ | B. | ①④⑥ | C. | ②③⑥ | D. | ①④⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com