
用铅蓄电池作电源电解某溶液100mL。已知该溶液中含SO2、KI,其物质的量的浓度均为
0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是 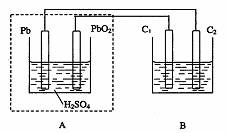
A.铅蓄电池工作一段时间后A溶液的pH变小
B.当B烧杯中I-的浓度降为0.05mol/L时,消耗A中的H2SO4的物质的量为0.025mol
C.当C1、C2两极均产生气体时,应有至少3.6×1022个电子从电路中流过
D.铅蓄电池工作时负极电极反应式为:PbO2-2e-+H2SO4 PbSO4+2H2O+SO42-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
负极:Pb+![]()
![]() PbSO4+2e-
PbSO4+2e-
正极:PbO2+4H++![]() +2e-
+2e-![]() PbSO4+2H2O
PbSO4+2H2O
若制得0.050 mol Cl2,则电池内消耗的H2SO4的物质的量至少是( )
查看答案和解析>>
科目:高中化学 来源:浙江省临海市2009-2010学年度高二下学期第一次月考化学试题 题型:填空题
(10分)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O根据上述情况判断:
(1)蓄电池的负极是______,其电极反应式为______。
(2)蓄电池的正极是______,其电极反应式为______。
(3)蓄电池工作时,其中电解质溶液的pH______(增大、减小、不变)。
(4)实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com