
【题目】常温下,下列有关叙述正确的是
A. pH = 8的NaY溶液中,c(Na+) – c(Y-) = 9.9×10-7mol·L-1
B. Na2CO3溶液中,![]()
C. pH相等的①NH4NO3 ②(NH4)2SO4 ③NH4HSO4溶液中,![]() 大小顺序①>②>③
大小顺序①>②>③
D. 10 mL pH=12的NaOH溶液中加入pH = 2的HA溶液至pH = 7,则所得溶液体积一定为20 mL(忽略溶液混合时体积变化)
【答案】A
【解析】
A.常温下pH=8的溶液中氢离子浓度为1×10-8mol/L,氢氧根离子浓度为1×10-6mol/L,根据NaY溶液中的电荷守恒判断;B.根据碳酸钠溶液中的物料守恒判断;C.从两个角度考虑,一是相同pH的(NH4)2SO4与NH4NO3溶液的水解程度是否相等,二是NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,以此来解答;D.需要根据HA的电解质类型判断,若HA为强电解质,则HA溶液体积为10mL,若为弱酸,则消耗酸的体积小于10mL。
A、pH = 8的NaY溶液中存在电荷守恒c(Na+) + c(H+) = c(Y-)+ c(OH-),则c(Na+) – c(Y-) = c(OH-)- c(H+)= 9.9×10-7mol·L-1,选项A正确;B、Na2CO3溶液中,根据物料守恒有![]() ,选项B错误;C、相同pH的(NH4)2SO4与NH4NO3溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4,则pH相等时溶液浓度大小为①=②>③,选项C错误;D.10mL pH=12NaOH溶液中加入pH=2的HA溶液至pH刚好等于7,若HA为强电解质,则HA溶液体积为10mL,若为弱酸,则消耗酸的体积小于10mL,所以溶液体积V(总)≤20 mL,选项D错误;答案选A。
,选项B错误;C、相同pH的(NH4)2SO4与NH4NO3溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4,则pH相等时溶液浓度大小为①=②>③,选项C错误;D.10mL pH=12NaOH溶液中加入pH=2的HA溶液至pH刚好等于7,若HA为强电解质,则HA溶液体积为10mL,若为弱酸,则消耗酸的体积小于10mL,所以溶液体积V(总)≤20 mL,选项D错误;答案选A。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】工业生产硝酸的尾气中含有氮氧化物NO、(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。工业上常用Na2CO3溶液吸收法处理NOx。
已知:NO不能与Na2CO3溶液反应
NO+NO2+Na2CO3=2NaNO2+CO2 (I)2NO2+Na2CO3=NaNO2+NaNO3+CO2 (II)
将lmolNOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3-、NO2-两种离子的物质的量随x变化关系如图所示。下列说法正确的是

A. 当NOx被Na2CO3溶液完全吸收时,x的值可能是1.3
B. 用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出) 时,吸收液质量就增加44g,则NOx中的x值为1.875
C. 图中线段a表示NO3-离子的物质的量随x值变化的关系
D. 若用溶质质量分数为21.2%的Na2CO3溶液吸收,则需要Na2CO3溶液至少150g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是人体必需的微量元素,含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用,请回答下列问题:
(1)Co基态原子的电子排布式为_____________;
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学中的光敏剂、催化剂等方面得到了广泛的应用,其结构如图所示,中心离子为钴离子。

①酞菁钴中三种非金属原子的电负性有大到小的顺序为_____________,(用相应的元素符号作答);碳原子的杂化轨道类型为_____________;
②与钴离子通过配位键结合的氮原子的编号是_____________;
(3)CoCl2中结晶水数目不同呈现不同的颜色。
CoCl2·6H2O(粉红)![]() CoCl2·2H2O(紫红)
CoCl2·2H2O(紫红)![]() CoCl2·H2O(蓝紫)
CoCl2·H2O(蓝紫)![]() CoCl2(蓝色)
CoCl2(蓝色)
CoCl2可添加到硅胶(一种干燥剂,烘干后可再生反复使用)中制成变色硅胶。简述硅胶中添加CoCl2的作用:_____________;
(4)用KCN处理含 Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN6]4-,该配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,写出该反应的离子方程式:_____________;
(5)Co的一种氧化物的晶胞如图所示( ),在该晶体中与一个钴原子等距离且最近的钴原子有_________个;筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述 CoO2的化学组成的是_____________。
),在该晶体中与一个钴原子等距离且最近的钴原子有_________个;筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述 CoO2的化学组成的是_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼的熔点为-107.3 ℃,沸点为12.5 ℃,易水解生成硼酸(H3BO3),可用于制造高纯硼、有机合成催化剂等。实验室制取三氯化硼的原理为B2O3+3C+3Cl2![]() 2BCl3+3CO。
2BCl3+3CO。
(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。

①装置B中盛放的试剂是__,装置C的作用是___________________。
②装置A中发生反应的离子方程式为 _____________________________。
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。
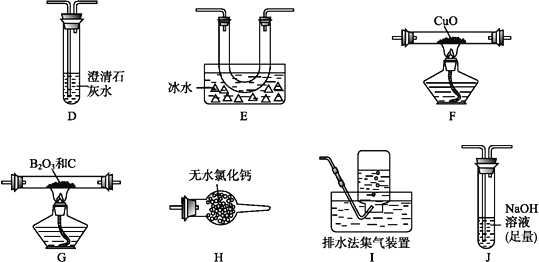
①乙组同学的实验装置中,依次连接的合理顺序为
A→B→C→G→__→__→__→__→F→D→I。
②能证明反应中有CO生成的现象是___________________________。
③开始实验时,先点燃____(填“A” 或“G”)处的酒精灯。
④请写出BCl3水解的化学方程式__________________________。
⑤硼酸是一元弱酸,其钠盐化学式为Na [B(OH)4],则硼酸在水中电离方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应框图填空。已知反应①是工业上生产化合物D的反应,反应⑤是实验室检验化合物E的反应。

(1)单质L是________;化合物A是________。
(2)图中除反应①以外,还有两个用于工业生产的反应,是________和________(填代号)。它们反应的化学方程式分别是:______________________和_____________________。
(3)E和K、J混合溶液反应的化学方程式为____________________。此反应的发生说明了_____________________________________________________________________。
(4)把K、J混合固体放入少量浓盐酸中,则其反应的现象是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NH4Cl和Ca(OH)2制取氨气,下图A和B是常用的气体发生装置。

(1)实验室制氨气时反应的化学方程式是______________________________________,应选用的装置是_____;若改用浓氨水和NaO固体制氨气时,应选取的装置是________。
(2)为了得到干燥的氨气,实验室常使用________做干燥剂(请从碱石灰、浓硫酸、氯化钠中选出一种物质)。
(3)实验室常用_______法收集氨气。在标准状况下,将盛满氨气的集气瓶倒置于水中(假设溶质全部在集气瓶内),则所得溶液的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下图所示实验装置的 K 闭合,下列判断正确的是

A. Cu电极上发生还原反应 B. 电子沿 Zn→a→b→Cu路径流动
C. 片刻后甲池中c(SO![]() )增大 D. 片刻后可观察到滤纸b点变红色
)增大 D. 片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g)△H=-a kJmol-1。
2HI(g)△H=-a kJmol-1。
已知:

下列说法正确的是( )
A. 该反应为吸热反应
B. 断开2 mol HI分子中的化学键所需能量约为(c+b+a)kJ
C. 反应物的总能量低于生成物的总能量
D. 向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com