
| A、c(CO32-)>c(H2CO3) |
| B、c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
| C、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、c(Na+)=c(HCO3-)+c(CO32-) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、甲烷 | B、丙烷 | C、丁烷 | D、戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氟元素半径小,电负性高,可与金属或非金属生成最高价化合物,如MnF2、SF6等.
氟元素半径小,电负性高,可与金属或非金属生成最高价化合物,如MnF2、SF6等.查看答案和解析>>
科目:高中化学 来源: 题型:
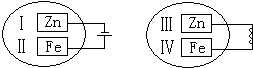 把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,两个实验中,观察到的现象和对应方程式都正确的是( )
把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,两个实验中,观察到的现象和对应方程式都正确的是( )| A、Ⅰ附近溶液变红,Zn-2e-=Zn2+ |
| B、Ⅳ附近溶液变红,O2+2H2O+4e-=4OH- |
| C、Ⅱ附近有黄绿色气体生成,2Cl--2e-=Cl2↑ |
| D、Ⅲ附近有无色气体生成,2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 NaOH溶液:K+、Ba2+、Cl-、HCO3- |
| B、0.1 mol?L-1 Na2CO3溶液:K+、NH4+、NO3-、SO42- |
| C、0.1 mol?L-1 FeCl3溶液:K+、Na+、I-、SCN- |
| D、0.1 mol?L-1 HCl的溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
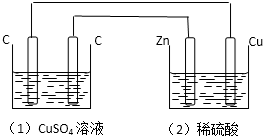 如图装置中,溶液体积均为200ml,开始时,电解质溶液的浓度均为0.1mol?L-1,工作一段时间后,测得导线上通过了0.02mol 电子,若不考虑溶液体积的变化,下列叙述中正确的是( )
如图装置中,溶液体积均为200ml,开始时,电解质溶液的浓度均为0.1mol?L-1,工作一段时间后,测得导线上通过了0.02mol 电子,若不考虑溶液体积的变化,下列叙述中正确的是( )| A、(1)、(2)两装置均为电解池 |
| B、(1)、(2)溶液的PH均减小 |
| C、(1)中阳极电极反应式为:4OH--4e-═2H2O+O2↑ |
| D、(1)中阴极上析出0.32 g Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
 探究实验发现,硝酸发生氧化还原反应时,浓度越稀,对应还原产物中氮元素的化合价越低.
探究实验发现,硝酸发生氧化还原反应时,浓度越稀,对应还原产物中氮元素的化合价越低.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、M>N | B、M<N |
| C、M=N | D、无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对煤进行脱硫、液化、气化加工,提高煤的综合利用率 |
| B、研究以植树秸秆为原料制取生物柴油 |
| C、为加快融雪,在高速路面上大范围使用融雪剂 |
| D、进行以“设计绿色化工工艺,提高原子利用率”为目标的技术革新 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com