
【题目】某二元酸(H2A)在水中的电离方程式是H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
(1)Na2A溶液显_________(填“酸性”“中性”或“碱性”)。理由是__________(用离子方程式表示)。
(2)已知0.1mol/L的NaHA溶液的pH=2,则0.1mol/L的H2A溶液中c(H+ )_______(填“<”“>”或“=”)0.11mol/L。
(3)在0.1mol/L的Na2A溶液中,下列微粒浓度关系式不正确的是__(填字母)。
A.c(A2- )+c(HA-)=0.1mol/L
B.c(OH-)=c(H+) +c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(4)若向0.1mol/L的H2A溶液中加入等体积等浓度的NaOH溶液,则溶液中各离子浓度由大到小的顺序为__________________。
【答案】 碱性 A2-+H2O![]() HA-+OH- < C c(Na+)>c( HA- )>c(H+ )>c(A2- )>c(OH- )
HA-+OH- < C c(Na+)>c( HA- )>c(H+ )>c(A2- )>c(OH- )
【解析】试题分析:本题考查水解离子方程式的书写,溶液中粒子浓度的大小关系。
(1)由于H2A第一步为完全电离,第二步为部分电离,所以Na2A溶液中A2-只发生一步水解:A2-+H2O![]() HA-+OH-,Na2A溶液呈碱性。
HA-+OH-,Na2A溶液呈碱性。
(2)NaHA在水中的电离方程式为:NaHA=Na++HA-,HA-![]() H++A2-,0.1mol/LNaHA溶液的pH=2,溶液中c(H+)=0.01mol/L;H2A在水中的电离方程式为:H2A=H++HA-,HA-
H++A2-,0.1mol/LNaHA溶液的pH=2,溶液中c(H+)=0.01mol/L;H2A在水中的电离方程式为:H2A=H++HA-,HA-![]() H++A2-,0.1mol/LH2A溶液中第一步电离出的c(H+)=0.1mol/L,由于第一步电离产生的H+对第二步电离起抑制作用,所以0.1mol/LH2A溶液中c(H+)
H++A2-,0.1mol/LH2A溶液中第一步电离出的c(H+)=0.1mol/L,由于第一步电离产生的H+对第二步电离起抑制作用,所以0.1mol/LH2A溶液中c(H+)![]() 0.11mol/L。
0.11mol/L。
(3)由于H2A第一步为完全电离,第二步为部分电离,所以Na2A溶液中A2-只发生一步水解:A2-+H2O![]() HA-+OH-。A项,根据“A”守恒:c(A2-)+c(HA-)=0.1mol/L,正确;B项,溶液中的电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),物料守恒为:2[c(A2-)+c(HA-)]=c(Na+),整理得c(OH-)=c(H+)+c(HA-),正确;C项,溶液中的电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),错误;D项,溶液中的物料守恒为: c(Na+)= 2[c(A2-)+c(HA-)],正确;答案选C。
HA-+OH-。A项,根据“A”守恒:c(A2-)+c(HA-)=0.1mol/L,正确;B项,溶液中的电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),物料守恒为:2[c(A2-)+c(HA-)]=c(Na+),整理得c(OH-)=c(H+)+c(HA-),正确;C项,溶液中的电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),错误;D项,溶液中的物料守恒为: c(Na+)= 2[c(A2-)+c(HA-)],正确;答案选C。
(4)等体积等浓度的H2A溶液与NaOH溶液反应得NaHA溶液,在NaHA溶液中存在以下电离:NaHA=Na++HA-,HA-![]() H++A2-,H2O
H++A2-,H2O![]() H++OH-,HA-、H2O的电离都很微弱,但HA-的电离大于H2O的电离,所以溶液中离子浓度由大到小的顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
H++OH-,HA-、H2O的电离都很微弱,但HA-的电离大于H2O的电离,所以溶液中离子浓度由大到小的顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。


科目:高中化学 来源: 题型:
【题目】(1)已知某反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答问题。
C(g)+D(g)过程中的能量变化如图所示,回答问题。
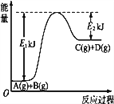
该反应是____(填“吸热”或“放热”)反应,该反应的ΔH=_____ kJ· mol-1(用含E1、E2的代数式表示)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l) =H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式___________________________。
(3)已知:H2(g)+Cl2(g)==2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为______kJ。
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示AE五种物质间的相互转化关系,其中A为淡黄色固体,B为单质。试推出各物质的化学式,并写出B→C、C→D、D→E反应的化学方程式。
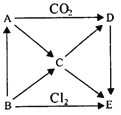
(1)写出B→C、C→D、D→E反应的化学方程式:
B→C:_______________;
C→D:_______________;
D→E:_______________;
(2)将3.9 gA投入到足量的水中充分反应,生成的气体在标准状况下的体积为_____L,将反应后的溶液配成1000mL溶液,所得溶液的物质的避浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是( )
A.金属氧化物都是碱性氧化物
B.氨水和液氯都是纯净物
C.CuSO4溶液和Al(OH)3胶体都能产生丁达尔效应
D.碳酸氢钠属于盐类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据物质的分类标准可将一种物质归属多个类别。现有下列物质:
①![]() ②CH2=CH2 ③
②CH2=CH2 ③![]() ④CH3CH2CH2CH3
④CH3CH2CH2CH3
⑤![]() ⑥
⑥![]() ⑦CH3CHO ⑧
⑦CH3CHO ⑧![]()
(1)⑥中的官能团名称为___________;⑦中的官能团名称为_____________。
(2)属于烯烃的有__________(填序号,下同)。
(3)属于同分异构体的有____________________。
(4)属于芳香烃的有_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短用期元素W、X、Y、Z的原子序数依次增大,a、b、c、d 是由W、X、Z这三种元素组成的二元化合物,其中a、c具有漂白性;e是元素Z形成的黄色固体单质;X与Z位于同主族;Y是同周期中原子半径最大的元素。上述物质在常温下的转化关系如图所示,下列说法不正确的是

A. X、Y 形成的简单离子的半径大小:X<Y
B. Z的最高价氧化物的水化物为强酸
C. a、b和c两两之间均能发生化学反应
D. Y与Z形成的化合物溶于水可促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3+6HCl=3Cl2+KCl +3H2O,
③2KBrO3+Cl2=Br2+ 2KClO3,下列说法正确的是
A. 上述三个反应都有单质生成,所以都是置换反应
B. 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C. 反应②中还原剂与氧化剂的物质的量之比为6:1
D. ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O![]() +O2+xOH-=Fe3O4↓+S4O
+O2+xOH-=Fe3O4↓+S4O![]() +2H2O。请回答下列问题。
+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是____________。
(2)反应的化学方程式中x=________。
(3)每生成1 mol Fe3O4,反应转移的电子为________mol,被Fe2+还原的O2的物质的量为________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com