
分析 (一)根据实验中原因的分析可知,①应该是Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
②Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大);
(二)要证明原因Ⅲ正确,则实验1反应反应速率加快,而在实验2中反应速率减慢.
解答 解:(一)①根据原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响提出相反猜想,
故答案为:Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
②根据原因ⅣCl-、SO42-均对反应具有促进作用,但Cl-影响更小提出相反猜想,
故答案为:Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大);
(二)③根据原因ⅢCl-对反应具有促进作用,而SO42-对反应具有阻碍作用推测,
故答案为:反应速率加快;
④根据原因ⅢCl-对反应具有促进作用,而SO42-对反应具有阻碍作用推测,
故答案为:反应速率减慢.
点评 本题考查外界条件对反应速率的影响,题目难度中等,明确对照试验的设计原则为解答关键,注意掌握影响化学反应速率的因素,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 喷水冷却燃烧物,冷却灭火 | B. | 沙土覆盖燃烧物,窒息灭火 | ||
| C. | 移开易燃易爆物,隔离灭火 | D. | 喷入化学灭火剂,抑制灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
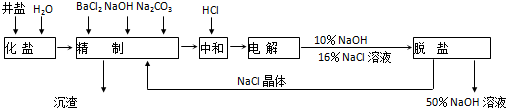
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| NaOH/g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
| NaCl/g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)混合缩合,最多可形成3种二肽 | |
| C. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| D. | 将电石与饱和食盐水反应生成的气体通入溴的四氯化碳溶液中,若溶液褪色,证明有乙炔生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
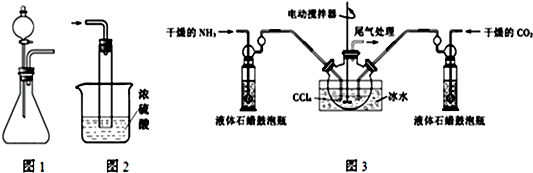
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L HF中含HF分子数目为NA | |
| B. | 60 g石英晶体中含有的Si-O键数目为2 NA | |
| C. | 标准状况下,11.2 L Cl2通人足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA | |
| D. | l L 0.1 mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


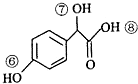 )的说法正确的是AD.
)的说法正确的是AD.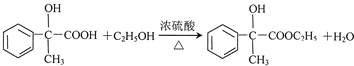 .
.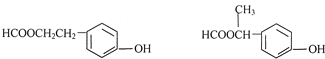 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com