
| A. | ②④⑥ | B. | ①③⑤ | C. | ③④⑥ | D. | ①②⑤ |
分析 ①酸是指电离出来的阳离子全部是氢离子的化合物,碱是指电离出来阴离子全部是氢氧根离子的化合物,盐是指电离出金属离子和酸根离子的化合物,氧化物是两种元素组成,其中一种是氧元素的化合物;
②电解质是指在水溶液里或熔化状态下能够导电的化合物,水溶液中全部电离的化合物为强电解质,水溶液中部分电离的化合物为弱电解质,非电解质是指在水溶液里和熔化状态下都不能够导电的化合物,据此可以分析各种的所属类别;
③碱性氧化物是能和酸反应生成盐和水的氧化物;酸性氧化物是能和碱反应生成盐和水的氧化物;两性氧化物是不但可以和酸反应还可以和碱反应均生成盐和水的氧化物;
④电解质的强弱是根据电解质的电离程度,而不是导电性;
⑤根据反应中是否有电子转移将化学反应分为是氧化还原反应和非氧化还原反应;
⑥能够与碱反应只生成盐和水的氧化物为酸性氧化物.
解答 解:①依据概念分析,硫酸、烧碱(氢氧化钠)、醋酸钠和水分别属于酸、碱、盐和氧化物,故①正确;
②蔗糖不能电离属于非电解质,硫酸钡是盐属于强电解质,水是弱电解质,故②正确;
③Na2O、Fe2O3属于碱性氧化物,Al2O3既能和酸反应又能和碱反应生成盐和水,是两性氧化物,故③错误;
④电解质水溶液中完全电离的电解质为强电解质,水溶液中部分电离的电解质为弱电解质,溶液导电能力强弱和离子浓度大小有关,故④错误;
⑤根据反应中是否有电子转移将化学反应分为是氧化还原反应和非氧化还原反应,分类标准合理,故⑤正确;
⑥NO2与水反应除了生成酸还生成一氧化氮,不属于酸性氧化物,故⑥错误;
故选D.
点评 本题考查了物质分类的方法和依据,掌握物质组成和相关概念是解题关键,注意分类的方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 强酸、强碱、大多数盐是强电解质,弱酸、弱碱和水是弱电解质 | |
| B. | 电解质溶液导电性的强弱跟单位体积溶液里自由移动的离子多少有关 | |
| C. | 具有强极性共价键的化合物一定是强电解质 | |
| D. | 硫酸钠是强电解质,碳酸氢钠也是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体就是直径为10-9m~10-7m的微粒 | |
| B. | 实验室制备Fe(OH)3胶体的方法是将饱和FeCl3溶液滴入NaOH溶液并加热 | |
| C. | 电解Fe(OH)3胶体,阴极附近红褐色加深,是因为胶体带正电,向阴极移动 | |
| D. | 可以用丁达尔效应来区别胶体和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
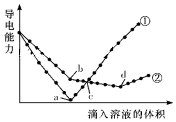 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )| A. | ②代表滴加H2SO4溶液的变化曲线 | |
| B. | b点溶液中大量存在的离子是SO42-、Na+、OH- | |
| C. | a、d两点对应的溶液均显中性 | |
| D. | c点两溶液中含有相同量的OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Z<Y<X<W | |
| B. | 气态简单氢化物的稳定性:Y<X | |
| C. | Q和M中的阴、阳离子个数比均为1:2,但化学键种类有差异 | |
| D. | Z与W能形成ZW或Z2W型离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Z>W | |
| B. | 对应的氢化物的热稳定性:R>W | |
| C. | X与Z、W与Z均以原子个数比1:1形成的化合物中化学键类型不完全相同 | |
| D. | R的最高价氧化物的水化物与NaHYO3溶液反应有气泡生成,证明非金属性:R>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 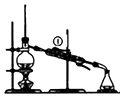 装置A可用于实验室制取蒸馏水,从①处通入冷却水 | |
| B. | 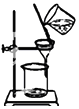 装置B可用于分离汽油和水,且汽油层由分液漏斗的下口放出 | |
| C. | 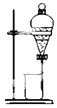 装置C可用于除去固体BaCl2中的BSaO4 | |
| D. | 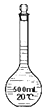 装置D在配制一定物质的量浓度的溶液之前可以有水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 0.5mol/L的Na2SO4水溶液中含有的氧原子数为2NA | |
| B. | 用含有0.2mo1 FeCl3的饱和溶液配制的氢氧化铁胶体中,胶粒数等于0.2NA | |
| C. | 1.0g H2O与D2O的混合物所含中子数为0.5NA | |
| D. | 标准状况下,11.2L氯气与足量铁粉充分反应,转移的电予数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com