
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
C
解析试题分析:X是短周期中最活泼的金属,且与R同周期,因此X是Na。R的最高价是+3价,则R是Al。Y和M的化合价都有-2价,应为周期表第ⅥA族元素,Y的最高价为+6价,应为S元素,M无正价,应为O元素;Z的化合价为+5、-3价,应为周期表第ⅤA族,原子半径小于硫元素原子半径而大于氧元素原子半径,故处于第二周期,为N元素。A、电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->O2->Al3+,故A正确;B、Z与M组成的化合物是NO或NO2,均是形成硝酸型酸雨的原因之一,故B正确;C、SO2溶于水显酸性,因此将SO2通入BaCl2溶液中,不能反应生成亚硫酸钡白色沉淀,故C错误;D、氢氧化铝属于两性氢氧化物,与氢氧化钠反应生成偏铝酸钠与水,与硫酸反应生成硫酸铝与水,故D正确,答案选C。
考点:考查元素周期表的结构以及元素周期律的应用


科目:高中化学 来源: 题型:单选题
下列关于元素的叙述正确的是( )
| A.金属元素与非金属元素能形成共价化合物 |
| B.只有在原子中,质子数才与核外电子数相等 |
| C.目前使用的元素周期表中,最长的周期含有36种元素 |
| D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图是元素周期表的一部分,下列关系正确的是
| S | Cl |
| Se | Br |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4,下列说法正确的是( )
| A.W、X、Y、Z的原子半径大小顺序是:W>X>Y>Z |
| B.Y的最高价氧化物对应水化物的酸性比Z的最高价氧化物对应水化物的酸性更强 |
| C.Y和Z形成的分子的空间构型可能是正四面体 |
| D.工业上用电解熔融的X和Z两元素组成的化合物来制取X的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列比较中正确的是
| A.金属性:Mg>Al>Na | B.原子半径:S>O>F |
| C.碱性:KOH>Mg(OH)2>NaOH | D.氢化物的稳定性:HBr>HCl>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下面有关14C、14N叙述正确的是( )
A.14C与14N有相同的中子数 B.14N的核外电子数与中子数相同
C.14C与14N有相同的质子数 D. 14C与14N互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是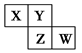
| A.元素W的最高价氧化物对应水化物的酸性最强 |
| B.单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z) |
| C.元素Y和元素Z的氢化物中均只存在极性共价键 |
| D.元素Y和元素Z的最高正化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 Cl、
Cl、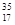 Cl为不同的核素,下列说法正确的是
Cl为不同的核素,下列说法正确的是
A. Cl2的摩尔质量是74 Cl2的摩尔质量是74 |
| B.通常情况下,氯气做氧化剂,但氯气也具有还原性 |
C. Cl、 Cl、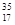 Cl互为同位素, Cl互为同位素,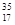 Cl2与 Cl2与 Cl2互为同素异形体 Cl2互为同素异形体 |
D.常温下,4.48L Cl2含有8NA个中子(NA为阿伏加德罗常数的值) Cl2含有8NA个中子(NA为阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期主族元素X、Y、Z、W的原子序数依次增大,元素X的原子半径最小,Y元素和X元素在一定条件下能形成YX,Z和W的原子序数相差8,W原子的电子总数是其电子层数的5倍。下列叙述正确的是( )
| A.Y可用于制造高性能可充电电池 |
| B.WX3的沸点高于ZX3 |
| C.Z的最高价含氧酸的酸性强于W的最高价含氧酸的酸性 |
| D.原子半径的大小顺序:rW>rZ>rY>rX |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com