
| 4.48L |
| 22.4L/mol |
| ||
| 2.24L |
| 22.4L/mol |
| 7.84L-2.24L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、H2SO4、纯碱、食盐 |
| B、HI、烧碱、胆矾 |
| C、H2CO3、乙醇、醋酸钠 |
| D、H3PO4、熟石灰、苛性钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
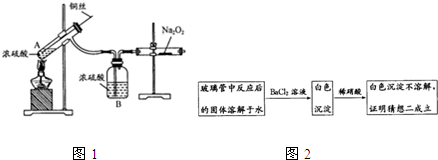
查看答案和解析>>
科目:高中化学 来源: 题型:
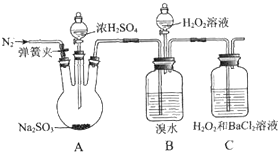 为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验).
为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验).| 实验操作 | 实验现象 |
| ⅰ.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| ⅲ.打开B中分流漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、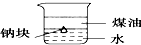 证明ρ(煤油)<ρ(钠)<ρ(水) |
B、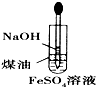 制备Fe(OH)2 |
C、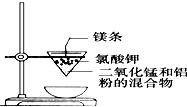 制取金属锰 |
D、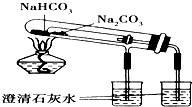 比较NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
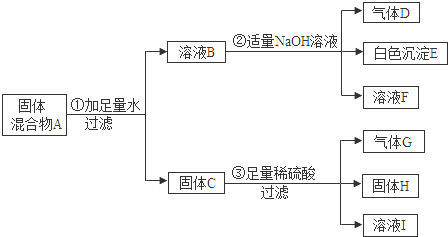
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com