
| 选项 | 实验操作(或设计) | 实验现象 | 结论 |
| A | 向溶液中滴加经盐酸酸化的BaCl2溶液 | 溶液中产生白色沉淀 | 溶液中含有SO42- |
| B | 以镁、铝、氢氧化钠溶液构成原电池 | 镁表面有气泡产生 | 镁作原电池的负极 |
| C | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升化 |
| D | 向KI溶液中滴入少量溴水和苯,振荡、静置 | 上层溶液呈紫红色 | I-的还原性强于Br- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.白色沉淀可能是AgCl;
B.原电池中易失电子的电极是负极,得电子的电极是正极;
C.升华是物理变化,只是物质状态的变化,不产生新物质;
D.同一氧化还原中,还原剂的还原性大于还原产物的还原性.
解答 解:A.向溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀,原溶液中可能含银离子,可能含硫酸根离子,但二者不能同时存在,故A错误;
B.Mg、Al、NaOH溶液构成的原电池中,该条件下Al易失电子作负极、Mg作正极,故B错误;
C.加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结,氯化铵不稳定,受热易分解生成氨气和氯化氢,冷却后二者反应又生成氯化铵,该反应过程中有新物质生成而属于化学变化,不属于升华,故C错误;
D.溴氧化碘离子生成碘单质,该反应中碘离子是还原剂、溴离子是还原产物,还原剂的还原性大于还原产物的还原性,所以I-的还原性强于Br-,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及还原性强弱判断、物理变化和化学变化判断、原电池正负极判断、离子检验等知识点,侧重考查学生分析判断能力,明确物质性质差异性是解本题关键,易错选项是B,注意:不能根据金属活动性强弱判断原电池正负极,为易错点.


科目:高中化学 来源: 题型:解答题
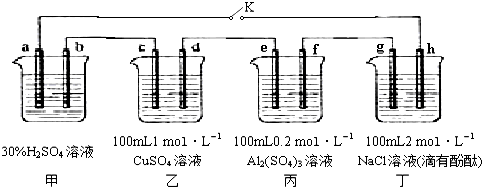
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag2O与CuCl反应的化学方程式为Ag2O+2CuCl═2AgCl+Cu2O | |
| B. | Ag2O溶于稀硝酸的离子方程式为Ag2O+2H+═2Ag++H2O | |
| C. | CuCl可以用铜在氯气中燃烧来制备 | |
| D. | 可以用稀硝酸来鉴别Ag2O与CuCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42.0g | B. | 21.3g | C. | 7.1g | D. | 3.55g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
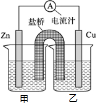 (1)已知下热化学方程式:
(1)已知下热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向亚磷酸溶液中加入过量的烧碱溶液(亚磷酸是二元弱酸):H3PO3+3OH-═PO33-+3H2O | |
| B. | 2mol•L-1的AlCl3溶液和7mol•L-1的NaOH溶液等体积混合:2Al3++7OH-═Al(OH)3↓+AlO${\;}_{2}^{-}$+2H2O | |
| C. | 用硝酸酸化的硝酸铁溶液可以刻蚀银饰:Fe3++Ag═Fe2++Ag+ | |
| D. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑥⑦ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com