
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀H2SO4和稀Ba(OH)2溶液反应生成2 mol H2O的反应热△H=-2×57.3 kJ/mol | |
| B. | 已知S(s)+$\frac{3}{2}$O2(g)═SO3(g)△H=-395.7 kJ/mol,则硫磺的燃烧热为395.7 kJ/mol | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,则金刚石比石墨稳定 | |
| D. | 已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol,则H2的燃烧热为285.8 kJ/mol |
分析 A.稀H2SO4和稀Ba(OH)2溶液反应生成2 mol H2O的同时还生成1 molBaSO4;
B.硫磺完全燃烧应生成二氧化碳气体;
C.物质具有的能量越低越稳定;
D.101kPa条件下,1mol氢气完全燃烧生成1mol液态水时放出的热量为氢气的燃烧热.
解答 解:A.稀H2SO4和稀Ba(OH)2溶液反应生成2 mol H2O的同时还生成1 molBaSO4,此时反应热△H<-2×57.3 kJ/mol,故A错误;
B.101kPa条件下,1mol固体硫完全燃烧生成1mol二氧化硫气体时放出的热量为硫磺的燃烧热,故B错误;
C.由热化学方程式可知,等物质的量的石墨比金刚石的能量低,因此石墨更加稳定,故C错误;
D.由热化学方程可知,H2的燃烧热为$\frac{1}{2}$×571.6 kJ/mol=285.8 kJ/mol,故D正确;
故选D.
点评 本题考查了中和热和燃烧热的定义,难度不大,明确中和热和燃烧热的定义是解题的关键,注意生成沉淀时也伴随着热效应.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
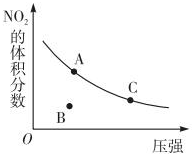
| A. | A、C两点的反应速率:v(A)>v(C) | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | B点正逆反应速率:v(正)>v(逆) | |
| D. | A、C两点气体的平均相对分子质量:A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g) 在反应中被氧化为1mol SO3(g) 的△H=-99kJ/mol.回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g) 在反应中被氧化为1mol SO3(g) 的△H=-99kJ/mol.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 2.6×10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴的四氯化碳溶液褪色 | |
| B. | NO2通入水中,红棕色逐渐褪去 | |
| C. | 往硝酸银溶液中滴加盐酸产生白色沉淀 | |
| D. | 甲烷和氯气在光照下反应,黄绿色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| B. | CH≡CH和CH2=CHCH=CH2互为同系物 | |
| C. | 乙酸乙酯在碱性条件下的水解反应皂化反应 | |
| D. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是实验室中制备气体或验证气体性质的装置图.回答下列问题:
如图是实验室中制备气体或验证气体性质的装置图.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com