
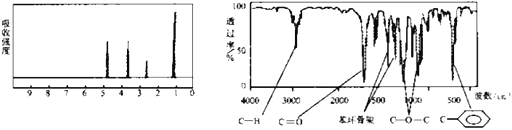
【题目】化合物A经李比希法和质谱法分析得知其分子式是C8H8O2,相对分子质量136。A的核磁共振氢谱有4个峰,峰面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有1个取代基,其核磁共振氢谱与红外光谱如下图。
请回答下列问题。
(1)A的结构简式是________。
(2)A的同分异构体(不含A)中属于酯类的芳香族化合物共有___种,请写出其中任意两种的结构简式_____。
【答案】![]() 5
5 ![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,任写其中两种即可。
,任写其中两种即可。
【解析】
(1)该有机物的分子式为C8H8O2,核磁共振氢谱有4个峰,峰面积之比为1:2:2:3,分子中只含一个苯环且苯环上只有1个取代基。红外光谱显示,分子中含有![]() 、C-O-C、C=O、C-H,则与苯环相连取代基只能为-COOCH3。
、C-O-C、C=O、C-H,则与苯环相连取代基只能为-COOCH3。
(2)书写A的同分异构体时,含有酯基,则苯环上的取代基可能为1个,可能为2个。若苯环上有2个取代基,则为-CH3、-OOCH;若为1个取代基,则可能为-CH2OOCH或-OOCCH3(不含A)。
(1)由以上分析知,A分子中只含有1个取代基,且此取代基为-COOCH3,所以A的结构简式是![]() 。答案为:
。答案为:![]() ;
;
(2)A的同分异构体(不含A)中,属于酯类的芳香族化合物共有5种。同分异构体中,可能含1个取代基,可能含2个取代基。若含1个取代基,可能为![]() 、
、![]() ;若含2个取代基,可能为
;若含2个取代基,可能为![]() 、
、![]() 、
、![]() ,任写其中两种即可。答案为:5;
,任写其中两种即可。答案为:5;![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,任写其中两种即可。
,任写其中两种即可。


科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)甲基的电子式为________,0.5 mol甲基中含有_____mol电子。
(2)丙烷的结构简式为________,该物质常温下为______(填“气态”“液态”或“固态”)。
(3)分子中含30个氢原子的烷烃的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝) +3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式_________。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______和________。含有12mol σ键的K4[Fe(CN)6的物质的量为________mol。
(3)黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为_____,电负性由大到小的排序为________。
(4)Fe、Na、K的晶体结构如图所示:
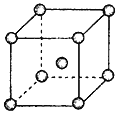
① 钠的熔点比钾更高,原因是__________________________。
② Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属与硝酸的反应,实验如下。

(1)Ⅰ中的无色气体是_________。
(2)Ⅱ中生成H2的离子方程式是______________。
(3)研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于![]() ,所以
,所以![]() 没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是____________。
没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是____________。
②乙同学通过分析,推测出![]() 也能被还原,依据是_____________,进而他通过实验证实该溶液中含有
也能被还原,依据是_____________,进而他通过实验证实该溶液中含有![]() ,其实验操作是____________。
,其实验操作是____________。
(4)根据实验,金属与硝酸反应时,影响硝酸还原产物不同的因素有__________;试推测还可能有哪些因素影响_________(列举1条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中微粒的物质的量浓度关系正确的是
A.CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L1]:c(Na+)=c(CH3COO)>c(CH3COOH)>c(H+)=c(OH)
B.20 mL 0.1 mol·L1 CH3COONa溶液中加入0.1 mol·L1盐酸至溶液pH=7:c(CH3COOH)=c(Cl)
C.0.1 mol·L1 CH3COOH溶液与0.1 mol·L1 Na2CO3溶液等体积混合(无气体逸出):c(![]() )>c(CH3COOH)+c(H2CO3)
)>c(CH3COOH)+c(H2CO3)
D.0.4 mol·L1 CH3COOH溶液和0.2 mol·L1 NaOH溶液等体积混合(pH<7):c(CH3COOH)>c(CH3COO)>c(Na+)>c(H+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol CO2与0.3 mol C在恒压密闭容器中发生反应:CO2(g) + C(s)2CO(g)。平衡时,体系中各气体的体积分数与温度的关系如图。已知:用气体分压表示的化学平衡常数KP = ![]() ;气体分压(P分) = 气体总压(P总) ×体积分数。下列说法正确的是
;气体分压(P分) = 气体总压(P总) ×体积分数。下列说法正确的是
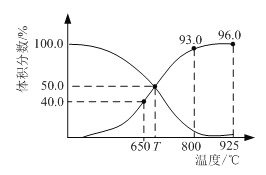
A.650℃时,CO2的平衡转化率为25%
B.800℃达平衡时,若充入气体He,v正 < v逆
C.T ℃达平衡时,若充入等体积的CO2和CO时,v正 > v逆
D.925℃时,用平衡气体分压表示的化学平衡常数KP = 23.04P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应H2SO4既表现氧化性,又表现出酸性的是
A.Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
B.Zn+ H2SO4==ZnSO4+H2↑
C.C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
D.CuO+ H2SO4=CuSO4 +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2RCHO+O2![]() 2RCOOH。现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
2RCOOH。现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
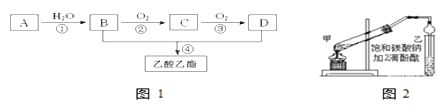
(1)B、D分子内含有的官能团分别是____、______(填名称)。
(2)写出下列反应的反应类型:①______,④________。
(3)B→C的反应方程式为____________
(4)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制取的主要步骤如下:
①在甲试管(如图2)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液。
②按如图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出有机层、洗涤、干燥。
a.若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:______,此装置中采用了球形干燥管,其作用是_________。
b.欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器是_____;分离时,乙酸乙酯应该从仪器____(填:“下口放” 或“上口倒”)出。
c.生成乙酸乙酯的反应是可逆反应,反应一段时间后,下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)______。
①混合物中各物质的浓度不再变化;
②单位时间里,生成1mol乙醇,同时生成1mol乙酸;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com